
【题目】软锰矿的主要成分MnO2,还含有Fe2O3、Al2O3、SiO2等,用软锰矿浆吸收工业废气中的二氧化硫,制备高锰酸钾的流程如图所示:
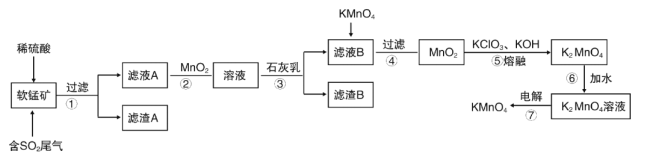
已知:滤液A中的金属阳离子主要是Mn2+还含有少量的Fe2+、Al3+等,几种离子开始沉淀和完全沉淀时的pH如右表所示:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 7.6 | 9.7 |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 4.7 |
Mn2+ | 8.3 | 9.8 |
根据上述流程,回答下列问题:
(1)写出软锰矿通入二氧化硫发生的主要反应的化学方程式__。
(2)滤渣A的成分是__,其中的化学键类型是___。
(3)步骤②中加入MnO2的作用__。
(4)有同学认为可以用碳酸锰(MnCO3)或氢氧化锰[Mn(OH)2]替代石灰乳,你是否同意此观点___?简述理由___。
(5)滤液B中加入KMnO4时发生反应的离子方程式是__。
(6)第⑦步用镍片(镍不参与反应)和铁板作电极,电解K2MnO4溶液可制备KMnO4。有关说法正确的是__(填字母)

A.a与电源的负极相连
B.离子交换膜为阳离子交换膜
C.阳极的电极反应为MnO42--e-=MnO4-
D.阴极的电解产物为KOH
【答案】SO2+MnO2=MnSO4 SiO2 共价键 将Fe2+氧化为Fe3+,便于沉淀 同意 MnCO3、Mn(OH)2与H+反应,调节溶液pH,使溶液中Fe3+、Al3+沉淀完全 3Mn2++2MnO4-+2H2O=5MnO2+4H+ BC
【解析】
已知,滤液A中的金属阳离子主要是Mn2+还含有少量的Fe2+、Al3+等,可知软锰矿通入二氧化硫发生的主要反应为:SO2+MnO2═MnSO4,SiO2不参与反应,滤渣A为SiO2,由离子开始沉淀及沉淀完全的pH可知,滤液A中加入MnO2是为了将Fe2+氧化为Fe3+,再加入石灰乳,调节溶液pH值,使Fe3+、Al3+转化为氢氧化铁、氢氧化铝沉淀,再进行过滤,滤渣B中主要有氢氧化铁、氢氧化铝,滤液B为MnSO4溶液,MnSO4溶液中加入KMnO4,发生氧化还原反应生成MnO2,MnO2被KClO3氧化生成K2MnO4,通过电解K2MnO4溶液生成KMnO4,据此分析解答。
已知,滤液A中的金属阳离子主要是Mn2+还含有少量的Fe2+、Al3+等,可知软锰矿通入二氧化硫发生的主要反应为:SO2+MnO2═MnSO4,SiO2不参与反应,滤渣A为SiO2,由离子开始沉淀及沉淀完全的pH可知,滤液A中加入MnO2是为了将Fe2+氧化为Fe3+,再加入石灰乳,调节溶液pH值,使Fe3+、Al3+转化为氢氧化铁、氢氧化铝沉淀,再进行过滤,滤渣B中主要有氢氧化铁、氢氧化铝,滤液B为MnSO4溶液,MnSO4溶液中加入KMnO4,发生氧化还原反应生成MnO2,MnO2被KClO3氧化生成K2MnO4,通过电解K2MnO4溶液生成KMnO4。
(1)由上述分析可知,软锰矿通入二氧化硫发生的主要反应为SO2+MnO2=MnSO4,故答案为:SO2+MnO2=MnSO4;
(2)由上述分析可知,滤渣A为SiO2,Si与O均为非金属元素的原子,则二者易形成共价键,故答案为:SiO2;共价键;
(3)滤液A中的金属阳离子主要是Mn2+还含有少量的Fe2+、Al3+等,根据几种离子开始沉淀和完全沉淀时的pH可知,不能直接沉淀Fe2+为氢氧化亚铁,因为Mn2+也会被沉淀,从而被过滤除去,因此应该先加入氧化剂将Fe2+氧化为Fe3+,再调节溶液的pH,将Fe3+、Al3+转化为沉淀,从而除去杂质,故答案为:将Fe2+氧化为Fe3+,便于沉淀;
(4)铁离子、铝离子比锰离子更易沉淀,加入MnCO3或Mn(OH)2与H+反应,调节溶液pH,使溶液中Fe3+、Al3+沉淀完全,再通过过滤除去,同意该同学的观点,故答案为:同意;MnCO3、Mn(OH)2与H+反应,调节溶液pH,使溶液中Fe3+、Al3+沉淀完全;
(5)滤液B 为MnSO4溶液,加入KMnO4,发生氧化还原反应生成MnO2,由化合价变化可知,+2价Mn2+与MnO4-中+7价Mn发生归中反应生成MnO2,根据得失电子守恒,电荷守恒、元素守恒配平反应的离子方程式为3Mn2++2MnO4-+2H2O=5MnO2+4H+,故答案为:3Mn2++2MnO4-+2H2O=5MnO2+4H+;
(6)该装置为电解池,电解K2MnO4溶液制备KMnO4,Mn元素化合价从+6价升高为+7价,失电子,发生氧化反应,则Ni电极为阳极,Fe电极为阴极,
A. Ni电极为阳极,则a与电源的正极相连,A项错误;
B. 阳极反应式为MnO42--e-=MnO4-,阴极反应式为:2H2O+2e-=H2↑+2OH-,离子交换膜为阳离子交换膜,K+通过离子交换膜从阳极移动向阴极,阴极得到KOH,B项正确;
C. 由以上分析知,阳极反应物为K2MnO4,生成物为KMnO4,则阳极反应式为MnO42--e-=MnO4-,C项正确;
D. 阴极是水电离的氢离子放电生成氢气和氢氧根离子,阴极反应式为:2H2O+2e-=H2↑+2OH-,则阴极的电解产物为H2和KOH,D项错误;故答案为:BC。


科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是(已知Ksp(AgCl)=4.0×10-10,Ksp(AgBr)=4.9×10-13,Ksp(Ag2CrO4)=2.0×10-12)
A.0.lmol·L-1 NH4HS溶液中有:c(NH4+)+c(NH3·H2O)>c(HS-)+c(S2-)
B.将AgCl和AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,AgCl沉淀质量大于AgBr沉淀
C.向浓度均为1×10-3mol/L的KCl和K2CrO4混合液中滴加1×10-3mol/LAgNO3溶液,CrO42-先形成沉淀
D.常温下,pH=4.75、浓度均为0.l mol/L的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应2NO2![]() 2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③混合气体的平均相对分子质量不再改变的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
A.①③④ B.①④⑥ C.②③⑤ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al、Cu、Fe及其化合物常用于制备溴苯、乙醛反应的催化剂,也可以与CO、CN-、SCN-、N3-、NO2-、NH3、H2O等形成配合物。回答下列问题:
(1)Cu+基态核外电子排布式为________。
(2)Mg、Al、Si原子的第一电离能由大到小的顺序为________。
(3)CO、H2O、 CN-、SCN-、N3-、NH3中,有________对等电子体。
(4)乙醛分子中C原子轨道杂化的类型是________。等物质的量的溴苯和乙醛所包含的σ键的数目之比为________。
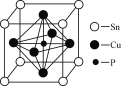
(5)磷青铜的晶胞结构如图所示,该晶体中铜、锡、磷三种原子的数目之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚碳酸酯(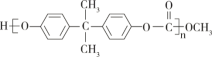 )的透光率良好。它可制作车、船、飞机的挡风玻璃,以及眼镜片、光盘、唱片等。它可用绿色化学原料X(
)的透光率良好。它可制作车、船、飞机的挡风玻璃,以及眼镜片、光盘、唱片等。它可用绿色化学原料X(![]() )与另一原料Y反应制得,同时生成甲醇。下列说法不正确的是
)与另一原料Y反应制得,同时生成甲醇。下列说法不正确的是
A. Y的分子结构中有2个酚羟基 B. Y的分子式为C15H18O2
C. X的核磁共振氢谱有1个吸收峰 D. X、Y生成聚碳酸酯发生的是缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是二元弱酸,KHC2O4溶液呈酸性。向10mL 0.01mol·L-1的H2C2O4溶液滴加0.01mol·L-1KOH溶液V(mL),回答下列问题。
(1)当V<10mL时,反应的离子方程式为___。
(2)当V=10mL时,溶液中HC2O4-、C2O42-、H2C2O4、H+的浓度从大到小的顺序为___。
(3)当V=a mL时,溶液中离子浓度有如下关系:c(K+)=2c(C2O42-)+(HC2O4-);当V=b mL时,溶液中离子浓度有如下关系:c(K+)= c(C2O42-)+c(HC2O4-)+c(H2C2O4);则a___b(填“<”“=”或“>”)。
(4)当V=20mL时,再滴入NaOH溶液,则溶液中![]() 的值将___(填“变大”“变小”或“不变”)。
的值将___(填“变大”“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新鲜水果、蔬菜、乳制品中富含的维生素C,具有明显的抗衰老作用,但易被空气氧化.某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下: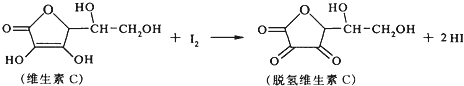
下列说法正确的是( )
A. 上述反应为取代反应
B. 维生素C不可溶于水,可溶于有机溶剂
C. 维生素C在酸性条件下水解只得到1种产物
D. 脱氢维生素C的分子式为C6H8O6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52g铜镁合金完全溶解于50mL浓度14.0mol/L的硝酸中,得到NO2和N2O4的混合气体1120ml(标准状况),向反应后的溶液中加入1.0mol/LNaOH溶液,当金属离子全部沉淀时得到2.54g沉淀。下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2:1
B.NO2和N2O4的混合气体中,NO2的体积分数是80%
C.得到2.54g沉淀时加入NaOH溶液的体积是600mL
D.溶解合金消耗HNO3的量是0.12mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同物质的量浓度的 HC1 溶液,分别滴定物质的量浓度均为 0.1 mol/L 的三种碱溶液,滴定 曲线如图所示。下列判断正确的是
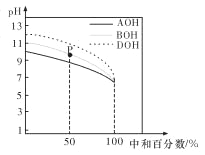
A. 滴定前,三种碱溶液中水电离出的 c(H+)大小关系: DOH>BOH>AOH
B. pH= 7 时,c(A+)=c(B+)=c(D+)
C. 滴定至 P 点时,溶液中:c(Cl-)>c(B+)>c(BOH)>c(OH-)>c(H+)
D. 当中和百分数达 100%时,将三种溶液混合后:c(AOH)+c(BOH)+c(DOH)=c(H+)-c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com