
| A. | NaCl | B. | NaCl NaBr | C. | NaCl NaBr NaI | D. | NaCl NaI |
分析 在Br-、I-中,还原性由弱到强为Br-<I-,向含有NaBr和NaI的混合溶液中通入一定量氯气发生:2NaI+Cl2=2NaCl+I2、2NaBr+Cl2=2NaCl+Br2,结合Br2和I2的性质分析.
解答 解:在Br-、I-中,还原性由弱到强为Br-<I-,向含有NaBr和NaI的混合溶液中通入一定量氯气发生:2NaI+Cl2=2NaCl+I2、2NaBr+Cl2=2NaCl+Br2,溴易挥发,碘易升华,
A.当氯气过量时,发生反应2NaI+Cl2=2NaCl+I2、2NaBr+Cl2=2NaCl+Br2,加热过程中,溴挥发,碘升华,所以剩余固体是氯化钠,故A不选;
B.当氯气少量时,发生反应2NaI+Cl2=2NaCl+I2,部分2NaBr+Cl2=2NaCl+Br2反应,加热过程中,碘升华,所以固体是氯化钠和溴化钠,故B不选;
C.当氯气少量时,只发生部分2NaI+Cl2=2NaCl+I2反应,加热过程中,碘升华,所以固体是氯化钠和溴化钠、碘化钠,故C不选;
D.当加入氯气,氯气先和碘离子反应,后和溴离子反应,所以固体是中不可能是氯化钠和碘化钠,故D选;
故选D.
点评 本题考查氧化还原反应,注意从氧化化合价的角度认识氧化还原反应的相关概念和相关物质的性质,答题时注意题给信息为解答该题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | K2SO4、HNO3、BaCl2 | B. | NaOH、NH4Cl、Mg(NO3)2 | ||
| C. | NH4HCO3、KCl、NaCl | D. | KMnO4、NaCl、H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁分别与氯气和稀盐酸反应所得氯化物相同 | |
| B. | 一定条件下,铁粉与水蒸气可在高温下反应生成氢氧化铁 | |
| C. | Fe3+中的Fe2+可用KSCN溶液检验 | |
| D. | 稀硫酸不能和铜反应,但在上述混合物中加入Fe2O3 后铜能溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
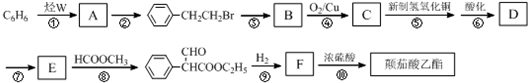
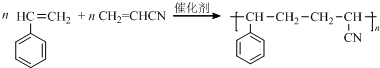 .
. .
.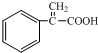 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| B. | 对CO(g)+NO2(g)═CO2(g)+NO(g)平衡体系增大压强可使其颜色变深 | |
| C. | 常温下,将1mLpH=3的醋酸溶液加水稀释到100mL,测得其pH<5 | |
| D. | 实验室中常用排饱和食盐水的方法收集氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 只有① | B. | 只有①④ | C. | 只有①⑤ | D. | ①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com