
分析 (1)纤维素在浓硫酸的催化作用下水解为葡萄糖;
(2)葡萄糖中含醛基,能将新制的氢氧化铜还原为氧化亚铜;
(3)乙醇和氧气在铜作催化剂条件下加热发生氧化还原反应生成乙醛,乙醛能继续被氧化为乙酸,据此分析官能团;
(4)在浓硫酸的催化作用下,乙醇和乙酸发生酯化反应生成乙酸乙酯和水;
(5)乙酸乙酯有香味;乙酸能和碳酸钠反应生成二氧化碳,而乙酸乙酯和碳酸钠溶液不反应;
(6)乙酸能和水混溶,但沸点不同;乙酸乙酯难溶于水;
(7)高分子化合物是相对分子质量在一万以上的化合物;不含碳元素的化合物为无机物;
(8)乙烯通过加聚反应生成聚乙烯.
解答 解:(1)纤维素在浓硫酸的催化作用下水解为葡萄糖,化学方程式为:(C6H10O5)n+nH20$→_{△}^{浓硫酸}$nC6H12O6,故答案为:(C6H10O5)n+nH20$→_{△}^{浓硫酸}$nC6H12O6:
(2)葡萄糖中含醛基,能将新制的氢氧化铜还原为氧化亚铜,故生成了砖红色沉淀,故答案为:生成砖红色沉淀;
(3)乙醇在铜做催化剂的条件下可被氧气氧化为乙醛,反应的化学方程式为2C2H5OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;乙醛能继续被氧化为乙酸,乙酸的官能团为羧基,结构简式为-COOH,故答案为:2C2H5OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;-COOH 羧基;
(4)在浓硫酸的催化作用下,乙醇和乙酸发生酯化反应生成乙酸乙酯和水,化学方程式为:C2H5OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,故答案为:C2H5OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;酯化反应;
(5)乙酸乙酯有香味,而乙酸有酸味,故可以不用化学试剂鉴别出;乙酸能和碳酸钠反应生成二氧化碳,而乙酸乙酯和碳酸钠溶液不反应,故可以用碳酸钠溶液鉴别出,故答案为:乙酸乙酯有香味,而乙酸有酸味;碳酸钠;
(6)乙酸能和水混溶,但沸点不同,故分离乙酸和水用分馏的方法;乙酸乙酯难溶于水,故乙酸乙酯和水分层,故可以用分液的方法分离,故答案为:蒸馏;分液;
(7)高分子化合物是相对分子质量在一万以上的化合物,故淀粉为高分子化合物,其余均不是;不含碳元素的化合物为无机物,故食盐是无机物,其余均为有机物,故答案为:淀粉;食盐;
(8)乙烯通过加聚反应生成聚乙烯,即反应类型为加聚反应,故答案为:加聚反应.
点评 本题考查了由醇到醛,然后由醛到酸,再由醇和酸生成酯的转化,难度不大,注意基础的掌握和知识的灵活运用.


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
| A. | N2$\stackrel{O_{2}}{→}$NO2$?_{Cu}^{H_{2}O}$HNO3 | |
| B. | Fe$\stackrel{HCl}{→}$FeCl2$?_{Fe}^{HCl}$FeCl3 | |
| C. | C$→_{点燃}^{O_{2}}$CO$?_{C,高温}^{O_{2},点燃}$CO2 | |
| D. | AgNO3(aq)$\stackrel{NH_{3}•H_{2}O}{→}$[Ag(NH3)2]OH(aq)$→_{△}^{蔗糖}$Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将53gNa2CO3溶于水配成500mL溶液 | |
| B. | 将40g氢氧化钠溶于1L水中 | |
| C. | 将1L10mol/L的NaCl溶液溶于9L水中 | |
| D. | 将22.4LHCl溶于水配成1L溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠是发酵粉的主要成分,而碳酸氢钠是治疗胃穿孔的一种药剂 | |
| B. | 硅酸钠的水溶液俗称水玻璃,可用作木材防火剂 | |
| C. | 大量生产一次性超薄塑料袋,方便人们日常生活 | |
| D. | 为补充人体所需的营养成分,人人都应食用添加营养强化剂的食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁在纯氧气中燃烧,生成最高价氧化物 | |
| B. | 铜与硫反应,生成黑色的CuS | |
| C. | 相同质量的铝分别与足量的盐酸和氢氧化钠溶液反应,生成氢气的量相同 | |
| D. | Na在氧气中燃烧主要生成Na2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体摩尔体积就是22.4 L•mol-1 | |
| B. | 1 mol H2所占的体积约为22.4 L | |
| C. | 在标准状况下,1 mol H2O(g)的体积是22.4 L | |
| D. | 在标准状况下,1 mol NH3和CO混合气体所占的体积约为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
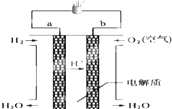 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com