
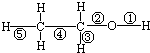
| A. | 与金属钠反应时,只有键①断裂 | B. | 在Ag催化下与O2反应时,键①、③断裂 | ||
| C. | 与CuO反应时,只有键①断裂 | D. | 与浓硫酸共热至170℃时,键②、⑤断裂 |
分析 A.与Na反应生成氢气,O-H键断裂;
B.在Ag催化下与O2反应时,生成醛,C-H、O-H键断裂;
C.与CuO发生氧化反应生成醛,C-H、O-H键断裂;
D.与浓硫酸共热至170℃时,生成乙烯,C-O和C-H键断裂.
解答 解:A.与Na反应生成氢气,O-H键断裂,即①断裂,故A正确;
B.在Ag催化下与O2反应时,生成醛,C-H、O-H键断裂,则键①、③断裂,故B正确;
C.与CuO发生氧化反应生成醛,C-H、O-H键断裂,则键①、③断裂,故C错误;
D.与浓硫酸共热至170℃时生成乙烯,C-O和C-H键断裂,键②、⑤键断裂,故D正确.
故选C.
点评 本题考查有机物的结构与性质,侧重乙醇性质的考查,注意乙醇的性质与官能团、化学键的关系,注重基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中溶液的酸性均减弱 | D. | 产生气泡的速率甲比乙慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
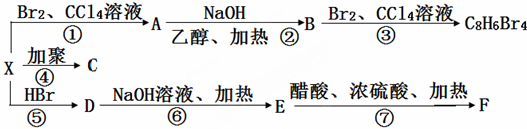
 ,C的结构简式:
,C的结构简式: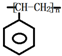 .
. .
.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素符号 | 元素性质或原子结构 |
| A | A是形成化合物最多的元素 |
| B | B元素的单质在空气中含量最多 |
| C | C元素在地壳中含量最多 |
| D | D元素在同周期中金属性最强 |
| E | 常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:4 | B. | 4:1 | C. | 2:1 | D. | 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 由水电离出c(H+)=10-3 mol•L-1的溶液中:Na+、AlO2-、NO3-、HCO3- | |
| C. | 无色溶液中可能大量存在Al3+、NH4+、Cl-、S2- | |
| D. | pH=12的溶液:K+、Na+、CH3COO-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成42.0L N2(标准状况) | |
| B. | 有0.250mol KNO3被氧化 | |
| C. | 转移电子的物质的量为1.25mol | |
| D. | 被氧化的N原子的物质的量为3.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
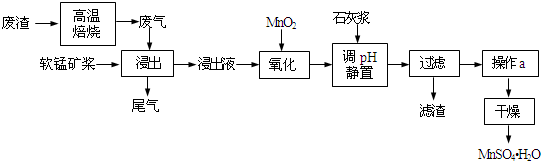
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH | 加碱溶解的pH |
| Fe2+ | 7.6 | 9.7 | |
| Fe3+ | 2.7 | 3.7 | |
| Al3+ | 3.8 | 4.7 | >8.5 |
| Mn2+ | 8.3 | 9.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com