
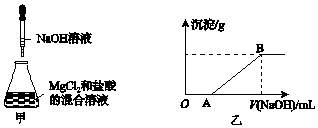
分析 溶解MgCl2固体,应该在烧杯里并且用玻璃棒不断的搅拌加速溶解;首先发生NaOH+HCl═NaCl+H2O,盐酸反应完毕,再发生反应再发生反应2NaOH+MgCl2=2NaCl+Mg(OH)2↓.
解答 解:首先发生NaOH+HCl═NaCl+H2O,盐酸反应完毕,再发生反应2NaOH+MgCl2=2NaCl+Mg(OH)2↓,
(1)溶解MgCl2固体,应该在烧杯里并且用玻璃棒不断的搅拌,故选:bd,
故答案为:bd;
(2)AB段反应的离子方程式为Mg2++2OH-=Mg(OH)2↓,故答案为:Mg2++2OH-=Mg(OH)2↓.
点评 本题以图象形式考查混合物的有关计算、物质性质分析,清楚各阶段发生的反应是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
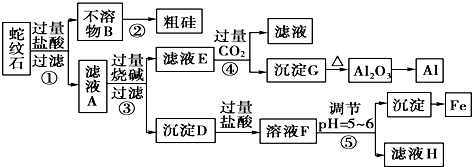
| 金属阳离子 | 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀时的pH |
| Fe3+ | 1.9 | 3.2 |
| Mg2+ | 9.4 | 11.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、Cl2都能使品红溶液褪色 | |
| B. | NH4Cl晶体、固体碘受热时都能气化 | |
| C. | 乙烯通入酸性高锰酸钾溶液和溴水都能使其褪色 | |
| D. | 葡萄糖、乙醛分别与新制Cu(OH)2共热时都能产生红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某无色溶液中可能大量存在H+、Cl-、MnO4- | |
| B. | 大量氢离子的溶液中可能大量存在Na+、NH4+、SiO32- | |
| C. | Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2 O2+2H+═2Fe3++2H2O | |
| D. | 稀硫酸与Ba(OH)2溶液的反应:H++SO42-+Ba2++OH-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀硫酸清洗铁锈(Fe2O3):Fe2O3+6H+═2Fe3++3H2O | |
| B. | 铝片与硝酸汞溶液反应:Al+Hg2+═Al3++Hg | |
| C. | 硫酸铜溶液和氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
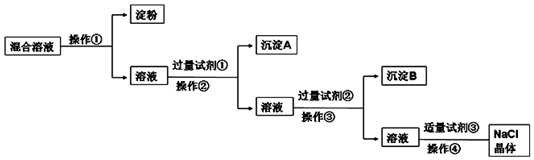
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 托盘天平 | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  | |
| 序号 | a | b | c | d | e | f |
| 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com