
【题目】向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。回答下列问题:
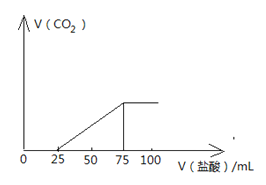
(1)原NaOH溶液的物质的量浓度为 ;
(2)题中通入CO2后所得溶液的溶质成分为 ,
若将所得溶质在低温低压条件下蒸干,所得固体物质(不带结晶水)的质量为 g
【答案】(1)1.5mol/L;(2)Na2CO3;NaHCO3;9.5g
【解析】
试题分析:(1)加入75mL盐酸时,二氧化碳的体积最大,此时,溶液中的溶质全部为NaCl,根据Na原子和Cl原子守恒,可知,![]() ,则原NaOH溶液的物质的量浓度为:
,则原NaOH溶液的物质的量浓度为:![]() ;(2)向NaOH溶液中通入CO2气体,可能发生的反应为:NaOH + CO2 = NaHCO3 或 2NaOH + CO2 = Na2CO3 + H2O;由于开始加入盐酸时,并无气体生成,因此题中通入CO2后所得溶液的溶质成分为Na2CO3和NaHCO3;通入盐酸25mL之前,Na2CO3和盐酸反应生成NaHCO3,方程式为:Na2CO3 + HCl = NaHCO3 + NaCl ,则Na2CO3的物质的量为:
;(2)向NaOH溶液中通入CO2气体,可能发生的反应为:NaOH + CO2 = NaHCO3 或 2NaOH + CO2 = Na2CO3 + H2O;由于开始加入盐酸时,并无气体生成,因此题中通入CO2后所得溶液的溶质成分为Na2CO3和NaHCO3;通入盐酸25mL之前,Na2CO3和盐酸反应生成NaHCO3,方程式为:Na2CO3 + HCl = NaHCO3 + NaCl ,则Na2CO3的物质的量为:![]() ,因此反应生成的NaHCO3的物质的量为0.05mol;加入25mL盐酸以后,NaHCO3和盐酸反应生成NaCl、水和二氧化碳,反应的方程式为:NaHCO3 + HCl = NaCl + H2O + CO2 ↑,因此NaHCO3的总的物质的量为:
,因此反应生成的NaHCO3的物质的量为0.05mol;加入25mL盐酸以后,NaHCO3和盐酸反应生成NaCl、水和二氧化碳,反应的方程式为:NaHCO3 + HCl = NaCl + H2O + CO2 ↑,因此NaHCO3的总的物质的量为:![]() ,因此溶液中原有的NaHCO3的物质的量为0.5mol,将所得溶质在低温低压条件下蒸干,所得固体物质(不带结晶水)的质量为
,因此溶液中原有的NaHCO3的物质的量为0.5mol,将所得溶质在低温低压条件下蒸干,所得固体物质(不带结晶水)的质量为![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是

A. 原子半径:Z>Y>X
B. 气态氢化物的稳定性:R>W
C. WX3和水反应形成的化合物是离子化合物
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关合金的叙述正确的是
A. 合金的导电性比成分金属强
B. 多数合金比成分金属熔点高,硬度小
C. 合金的机械强度比各成分金属小
D. 多数合金比成分金属熔点低,硬度大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出。在反应结束后的溶液中,逐滴加入4 mol/LNaOH 溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。下列说法不正确的是

A. O处溶液中的阳离子为:H+、Fe2+、Fe3+、Al3+
B. DE段反应的离子方程式为:NH4++OH-=NH3·H2O
C. 合金中,n(Al)=0.008mol
D. 欲测定F点沉淀的质量,实验步骤是:过滤、洗涤、干燥、称量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应过程能量变化如下所示:
H2(g)+Cl2(g)=2HCl(g)ΔH

下列说法错误的是
A.H—H键比Cl—Cl键稳定
B.正反应活化能比逆反应活化能高
C.ΔH= — 184.5 kJ·mol-1
D.在相同条件下,1mol H2(g)和1mol Cl2(g)分别在点燃和光照条件下反应生成2mol HCl(g),重新恢复到原来的状态时ΔH相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A的单质可形成分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期中简单离子半径最小的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13个电子。则
(1)A的元素符号______________,D的元素名称 ____________。
(2)C在周期表中的位置为第______周期______族,E的离子结构示意图________;
(3)B、C、E分别与A形成的化合物中最稳定的是________(写化学式);E、F的最高价氧化物对应的水化物的酸性较强的是________(写化学式)
(4)F的单质在反应中常作氧化剂,该单质的水溶液与E的低价氧化物反应的离子方程式为________________。
(5)X在纯净的C单质中可以安静的燃烧,生成B的单质。该方应的化学方程式为:__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com