
【题目】氯化亚铜(CuCl)可用于冶金、电镀等行业,其制备的一种工艺流程如下:
I.溶解:取海绵铜(主要含Cu和CuO),加入稀硫酸和NH4NO3的混合溶液,控制溶液温度在60~70℃,不断搅拌至固体全部溶解,得蓝色溶液(过程中无气体产生);
II.转化:向蓝色溶液中加入(NH4)2SO3和NH4Cl,充分反应后过滤,得到CuCl粗品;
III.洗涤:CuCl粗品依次用pH=2硫酸和乙醇洗涤,烘干后得到CuCl产品。
(资料)CuCl固体难溶于水,与Cl-反应生成可溶于水的络离子[CuCl2]-;潮湿的CuCl固体露置于空气容易被氧化。
(1)过程I中:
①本工艺中促进海绵铜溶解的措施有________。
②氧化铜溶解的离子方程式是________。
③充分反应后NH4+的浓度约为反应前的2倍,原因是________。
(2)过程II中:
①(NH4)2SO3的作用是_________。
②NH4Cl的用量对铜的沉淀率的影响如下图所示。
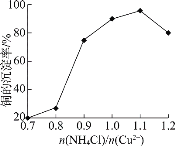
n(NH4Cl)/n(Cu2+)![]() 1.1时,CuCl的沉淀率下降的原因是________(用离子方程式表示)。
1.1时,CuCl的沉淀率下降的原因是________(用离子方程式表示)。
(3)过程III中,用乙醇洗涤的目的是________。
(4)产品纯度测定:量取CuCl产品a g于锥形瓶中,加入足量的酸性Fe2(SO4)3溶液使其充分溶解,然后用0.1000 mol/L KMnO4标准溶液滴定Fe2+,消耗KMnO4溶液b mL。(本实验中的MnO4-被还原为Mn2+,不与产品中杂质和Cl-反应)。
①CuCl溶于Fe2(SO4)3溶液的离子方程式是_________。
②产品中CuCl(摩尔质量为99g/mol)的质量分数为_________。
【答案】控制温度在60~70℃、不断搅拌 CuO + 2H+ = Cu2+ + H2O NO3-几乎全部被还原为NH4+ 还原剂 CuCl + Cl- = [CuCl2]- 去除CuCl固体表面的水,防止其被空气氧化 CuCl + Fe3+ = Cu2+ + Fe2++ Cl- ![]()
【解析】
I.溶解:溶解步骤的温度应控制在60~70℃,原因是温度低溶解速率慢,温度过高NH4NO3易分解,该步骤中Cu与NH4NO3反应的离子方程式为(N元素被还原到最低价)4Cu+NO3-+10H+=4Cu2++NH4++3H2O;
II.转化:发生反应的离子方程式为2Cu2++SO32-+2Cl-+H2O═2CuCl↓+SO42-+2H+;过滤得到固体为CuCl,滤液主要是硫酸铵和硫酸;
III.洗涤:CuCl粗品依次用pH=2硫酸和乙醇洗涤,去除CuCl固体表面的水,防止其被空气氧化,烘干后得到CuCl产品。
(1)①温度低溶解速率慢,温度过高NH4NO3易分解,本工艺中促进海绵铜溶解的措施有控制温度在60~70℃、不断搅拌。故答案为:控制温度在60~70℃、不断搅拌;
②氧化铜是碱性氧化物,与酸反应生成铜盐和水,氧化铜溶解的离子方程式是CuO + 2H+= Cu2++ H2O。故答案为:CuO + 2H+= Cu2++ H2O;
③充分反应后NH4+的浓度约为反应前的2倍,原因是:发生4Cu+NO3-+10H+=4Cu2++NH4++3H2O反应,NO3-几乎全部被还原为NH4+。故答案为:NO3-几乎全部被还原为NH4+;
(2)①根据发生的反应;2Cu2++SO32-+2Cl-+H2O═2CuCl↓+SO42-+2H+,(NH4)2SO3的作用是还原剂。故答案为:还原剂;
②n(NH4Cl):n(Cu2+)![]() 1.1时,Cl-浓度增大,与CuCl络合生成可溶的络合物,CuCl的沉淀率下降的原因是CuCl + Cl- = [CuCl2]-。故答案为:CuCl + Cl- = [CuCl2]-;
1.1时,Cl-浓度增大,与CuCl络合生成可溶的络合物,CuCl的沉淀率下降的原因是CuCl + Cl- = [CuCl2]-。故答案为:CuCl + Cl- = [CuCl2]-;
(3)过程III中,用乙醇洗涤的目的是去除CuCl固体表面的水,防止其被空气氧化。 故答案为:去除CuCl固体表面的水,防止其被空气氧化;
(4)①铁离子具有氧化性,能将CuCl氧化,CuCl溶于Fe2(SO4)3溶液的离子方程式是CuCl + Fe3+= Cu2++ Fe2++ Cl-。故答案为:CuCl + Fe3+= Cu2++ Fe2++ Cl-;
②根据电子守恒得关系式:5CuCl~5e-~KMnO4,产品中CuCl(摩尔质量为99g/mol)的质量分数为=![]() ==
== ![]() 。故答案为:
。故答案为:![]() 。
。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )
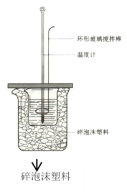
A.如图所示,测定中和热时,大小两烧杯间填满碎泡沫的作用是固定小烧杯
B.若用50mL 0.55mo1·L-1的氢氧化钠溶液,分别与50mL 0.50mo1·L-1的盐酸和50mL 0.50mo1·L-1硫酸充分反应,两反应测定的中和热不相等
C.加入NaOH溶液的正确操作是一次迅速加入
D.若用50mL 0.55mo1·L-1的氢氧化钠溶液与50mL 0.25 mol/L硫酸溶液反应测得中和热,NaOH溶液稍过量是没必要的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列叙述正确的是( )
为阿伏加德罗常数的值,下列叙述正确的是( )
A.![]() 由
由![]() 与
与![]() 组成的混合物中所含的质子总数为
组成的混合物中所含的质子总数为![]()
B.![]() 和
和![]() 所含的氢原子数均为
所含的氢原子数均为![]()
C.![]() 溶液在沸水中生成的胶体粒子数为
溶液在沸水中生成的胶体粒子数为![]()
D.![]() 乙醇与
乙醇与![]() 乙酸在浓硫酸的作用下充分反应,生成乙酸乙酯的数目为
乙酸在浓硫酸的作用下充分反应,生成乙酸乙酯的数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行X2(g)+4Y2(g)![]() 2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别是0.1mol·L-1、0.4mol·L-1、0.2mol·L-1、0.3mol·L-1当反应达到平衡后,各物质的物质的量浓度不可能是 ( )
2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别是0.1mol·L-1、0.4mol·L-1、0.2mol·L-1、0.3mol·L-1当反应达到平衡后,各物质的物质的量浓度不可能是 ( )
A.c(X2)=0.15mol·L-1B.c(Y2)=0.9mol·L-1
C.c(Z2)=0.3mol·L-1D.c(Q2)=0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知亚硫酸钠晶体与浓硫酸反应可以产生二氧化硫,按下图进行演示实验。
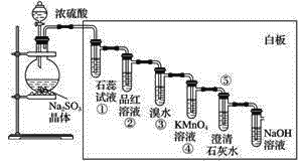
请回答下列问题:
(1)①中的实验现象是__________,说明二氧化硫具有的性质是__________。
(2)②中的实验现象是__________,证明二氧化硫有___________性。
(3)③中的实验现象是_______________,证明二氧化硫有____________性。
(4)④中的实验现象是__________,证明二氧化硫有______性。
(5)⑤中的实验现象是_____________,说明二氧化硫具有的性质是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中含有的少量杂质(括号内为杂质),所选试剂不正确的是
A.Cl2(HCl):饱和食盐水、浓硫酸
B.AlCl3溶液(Fe3+):氨水、盐酸
C.C2H2(H2S):CuSO4溶液、碱石灰
D.NaCl溶液(SO42-):BaCO3、盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为用惰性电极电解制备高锰酸钾的装置示意图如下。下列说法正确的是
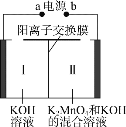
A.a为电源正极
B.Ⅰ中的K+通过阳离子交换膜移向Ⅱ
C.若不使用离子交换膜,KMnO4的产率可能会降低
D.若阴极产生0.2 mol气体,理论上可得到0.2 mol KMnO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是

A. Pt为阴极,Cu为阳极
B. b极的电极反应式是2H++2e-=H2↑
C. 电解过程中CuSO4溶液的pH逐渐增大
D. Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com