
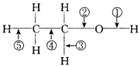
| A. | 和金属钠作用时,键②断裂 | |
| B. | 和浓H2SO4共热至170℃时,键②和⑤断裂 | |
| C. | 在Ag催化剂下和O2反应时,键①和③断裂 | |
| D. | 和CH2COOH共热时,键②断裂 |
分析 A.乙醇与与金属钠反应生成乙醇钠和氢气,故乙醇断键的位置为①;
B.乙醇和浓H2SO4共热至170℃时,发生消去反应,生成乙烯乙醇断键的位置为②和⑤;
C.乙醇在Ag催化下与O2反应生成乙醛和水,故乙醇断键的位置为①和③;
D.乙醇与CH3COOH反应生成乙酸乙酯和水,键①断裂.
解答 解:A.乙醇与与金属钠反应生成乙醇钠和氢气:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑,故乙醇断键的位置为①,故A错误;
B.乙醇和浓H2SO4共热至170℃时,发生消去反应,生成乙烯,反应方程式为CH3CH2OH$?_{170℃}^{浓硫酸}$CH2═CH2+H2O,故乙醇断键的位置为②和⑤,故B正确;
C.乙醇在Ag催化下与O2反应生成乙醛和水:2CH3CH2OH+O2$→_{△}^{Ag}$2CH3CHO+2H2O,故乙醇断键的位置为①和③,故C正确;
D.乙醇与CH3COOH反应生成乙酸乙酯和水:CH3CH2OH+CH3COOH→CH3COOCH2CH3+H2O,键①断裂,故D错误,
故选BC.
点评 本题考查乙醇的性质,难度不大.了解反应的机理是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中第3列的元素种类数最多 | |
| B. | 金属性最强的元素位于元素周期表的第1列 | |
| C. | 非金属性最强的元素位于元素周期表的第17列 | |
| D. | 能形成化合物的种类数最多的元素位于元素周期表的第16列 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag | B. | Zn(OH)2 | C. | Ag2O | D. | Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 原子半径:甲>乙 | |
| B. | 非金属性:乙>丁 | |
| C. | 最高价氧化物的水化物的酸性:丙<丁 | |
| D. | 最外层电子数:丙>丁>戊 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S原子结构示意图: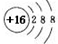 | |
| B. | 二氧化碳的电子式: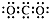 | |
| C. | H、D、T表示同一种核素 | |
| D. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}O$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | VII | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ | (11) |
 ;该氢化物常温下和元素④的单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑
;该氢化物常温下和元素④的单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌是正极,氧化银是负极 | |
| B. | 锌发生还原反应,氧化银发生氧化反应 | |
| C. | 溶液中OH-向正极移动,K+、H+向负极移动 | |
| D. | 在电池放电的过程中,电解质溶液的碱性变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将高锰酸钾晶体加热分解,所得固体质量减少 | |
| B. | 观察氯化钾溶液没有颜色,表明溶液中K+无色 | |
| C. | 在氯化钾溶液中加入适量锌粉振荡,静置后未见明显变化,表明锌与K+无反应 | |
| D. | 在高锰酸钾溶液中加入适量锌粉振荡,静置后见紫红色褪去,表明MnO4-离子为紫红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com