


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
| 元素编号 | 元素特征信息 | ||
| A | 其单质是密度最小的物质 | ||
| B | 其阴离子带两个单位的负电荷,单质是空气主要成分之一 | ||
| C | 其阳离子与B的阴离子具有相同的电子层结构,其原子的最外层电子数是次外层的
| ||
| D | 其氢氧化物和氧化物都有两性,且与C同周期 | ||
| E | 与C同周期,其原子半径在该周期最小 | ||
| R | 有多种化合价,其最高正价为+6价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 城市 | 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 甲 | 55 | SO2 | Ⅱ | 良 |
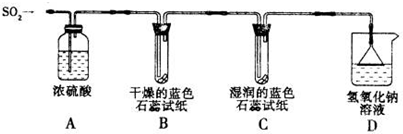
查看答案和解析>>
科目:高中化学 来源: 题型:
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 组别 | 被选出的物质 | 分类依据 |
| 第①组 | ||
| 第②组 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、按化学家的观点来看:世界上没有真正的垃圾,只是放错了地方的资源 |
| B、尽管可充电电池的使用寿命相对较长,但这类电池仍须进行回收处理 |
| C、对医疗垃圾主要采取焚烧法进行处理,因病毒全部杀死,焚烧产物可任意排放 |
| D、商品过度包装及其一次性的大量使用,既增加了垃圾量又造成了资源的极大浪费 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com