
下列说法中正确的是
A.某反应在低温条件下能自发进行,那么该反应在高温条件下也一定能自发进行
B.某反应在高温条件下不能自发进行,那么该反应在低温条件下也一定不能自发进行
C.反应方向是由焓变和熵变共同决定的,与反应温度无关
D.温度有可能对反应的方向起决定性作用
科目:高中化学 来源:2016届贵州省高三押题卷理综化学试卷(解析版) 题型:填空题
【物质与结构—选作】硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途。回答下列问题:
(1)写出基态镓原子的电子排布式 。
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),更高温度下Al2Cl6则离解生成A1Cl3单分子。
①固体氯化铝 的晶体类型是 ;
的晶体类型是 ;
②写出Al2Cl6分子的结构式 ;
③单分子A1Cl3的立体构型是 ,缔合双分子
Al2Cl6中Al原子的轨道杂化类型是 。
(3)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图),若其中有两个原子为10 B,其余为11B,则该结构单元有 种不同的结构类型。

(4)金属铝属立方晶系,其晶胞边长为405 pm,密度是2.70g·cm-3,计算确定其晶胞的类型(简单、体心或面心立方)  ;晶胞中距离最近的铝原子可看作是接触的,列式计算铝的原子半径r(A1)= pm。
;晶胞中距离最近的铝原子可看作是接触的,列式计算铝的原子半径r(A1)= pm。
查看答案和解析>>
科目:高中化学 来源:2016届安徽师大附中高三最后一卷理综化学试卷(解析版) 题型:实验题
亚氯酸钠(NaClO2)是一种高效氧化剂和漂白剂,主要用于棉纺、纸浆漂白和鱼药的制造。制备亚氯酸钠的工艺流程如下:

(1)要加快步骤①的反应速率,可采取的措施为 。(写一种即可)
(2)步骤①的离子方程式为 ,每生成标准状况下22.4L的ClO2,转移电子数为 。
(3)步骤②中H2O2的作用是 ;从“反应混合液”到“产品”的过程中先需蒸发溶剂,写出蒸发所需的硅酸盐仪器的名称 。
(4)NaClO2产品中通常混有少量NaCl。取样品wg,测得Na的物质的量为nmol,则该样品中NaClO2的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三热身考试理综化学试卷(解析版) 题型:选择题
Cyrneine A对治疗神经系统疾病有着很好的疗效。可用香芹酮经过多步反应合成:
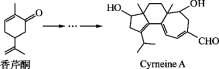
下列说法不正确的是( )
A. 香芹酮的分子式为C10H14O
B. Cyrneine A可以发生加成反应、消去反应和氧化反应
C. 香芹酮和Cyrneine A均能使酸性KMnO4溶液褪色
D. 与香芹酮互为同分异构体,分子中有4种不同化学环境的氢原子的酚类化合物共有3种
查看答案和解析>>
科目:高中化学 来源:2015-2016学年云南省高二下期中化学试卷(解析版) 题型:简答题
甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1〈0
CH3OH(g) △H1〈0
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3〉0
CO(g)+H2O(g) △H3〉0
回答下列问题:
(1)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。
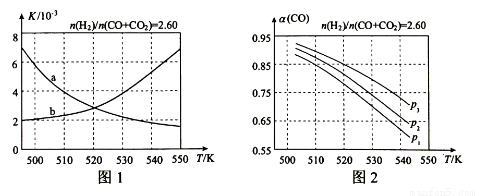
(2)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图2所示。a(CO)值随温度升高而 (填“增大”或“减小”),其原因是 。图2中的压强由大到小为_____,其判断理由是_____。
(3)Bodensteins研究了下列反应:2HI(g) H2(g)+I2(g)
H2(g)+I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0. 784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数, 其中k正、k逆为速率常数,则k逆为________(以K和k正表示)。若k正 = 0.0027min-1,在t=40min时,v正=__________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年云南省高二下期中化学试卷(解析版) 题型:选择题
将1molSO2和1molO2通入一容积不变的密闭容器中,在一定温度和催化剂作用下发生反应2SO2(g)+ O2(g) 2SO3(g)。达到平衡后SO3为0.3mol,此时若移走0.5molSO2和0.5mol O2,则重新达到平衡后SO3物质的量为
2SO3(g)。达到平衡后SO3为0.3mol,此时若移走0.5molSO2和0.5mol O2,则重新达到平衡后SO3物质的量为
A.等于0.3mol B.等于0.15mol
C.小于0.15mol D.大于0.15mol,小于0.3mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年天津市高一6月学业调研化学试卷(解析版) 题型:选择题
下列装置所示的实验中,能达到实验目的的是
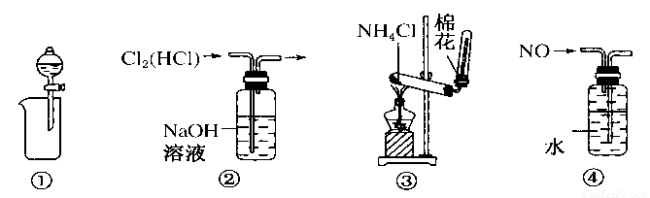

A.装置①用于分离苯和水 B.装置②用于除去Cl2中的HCl
C.实验室用装置③制氨气 D.用装置④排水法收集NO
查看答案和解析>>
科目:高中化学 来源:2015-2016学年天津市高一6月学业调研化学试卷(解析版) 题型:选择题
在密闭容器中加入2.0 mol SO2和1.0 mol O2,一定条件下发生如下反应2SO2+ O2 2SO3。反应达到平衡后,各物质的物质的量可能为
2SO3。反应达到平衡后,各物质的物质的量可能为
n(SO2)/mol | n(O2)/mol | n(SO3)/mol | |
A | 1.0 | 0 | 1.0 |
B | 0 | 0 | 2.0 |
C | 0.2 | 0.1 | 1.8 |
D | 1.5 | 0.75 | 1.0 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年天津市高二6月学业调研化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.乙酸与碳酸钠溶液反应:2H++CO32-==CO2↑+H2O
B.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O 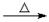 2C6H5OH+CO32-
2C6H5OH+CO32-
C.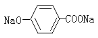 溶液中通入CO2气体:
溶液中通入CO2气体: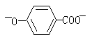 + CO2 +H2O—→
+ CO2 +H2O—→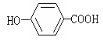 +CO32—
+CO32—
D.甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH-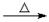 CO32-+2NH4+ + 4Ag↓+6NH3+2H2O
CO32-+2NH4+ + 4Ag↓+6NH3+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com