

分析 (1)熔融状态下,电解氧化铝生成铝和氧气;
(2)①用阳离子交换膜电解法除去工业品氢氧化钾溶液中的杂质含氧酸根,相当于电解水,阳极氢氧根离子放电;
②在阴极和阳极之间有阳离子交换膜,只允许阳离子K+和H+通过,这样就在阴极区聚集大量的K+和OH-,从而产生纯的氢氧化钾溶液,所以除去杂质后的氢氧化钾溶液从溶液出口在阴极区;
(3)①放电时,铁棒作负极,碳棒作正极,据此判断a的电极;失电子的物质发生氧化反应.
②铁失电子和氢氧根离子生成高铁酸根离子和水.
解答 解:(1)工业冶炼铝是利用惰性电极电极熔融氧化铝得到,阳极是氧离子失电子生成氧气,阴极是铝离子得到电子生成铝,反应的化学方程式为2Al2O3 $\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑,故答案为:2Al2O3 $\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑;
(2)①用阳离子交换膜电解法除去工业品氢氧化钾溶液中的杂质含氧酸根,相当于电解水,故电解时,阳极:4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
②在阴极区聚集大量的K+和OH-,从而产生纯的氢氧化钾溶液,除杂后的氢氧化钾溶液从出口B导出,故答案为:B;
(3)①放电时,铁作负极,碳棒作正极,所以放电时a是负极,b是正极;充电时,氢氧化镍失电子生成氧化镍,发生氧化反应.
故答案为:a;氧化反应.
②阳极上铁失电子和氢氧根离子反应生成高铁酸根离子和水,离子方程式为:Fe-6e-+8OH-=FeO42-+4H2O.
故答案为:Fe-6e-+8OH-=FeO42-+4H2O.
点评 本题考查原电池和电解池原理,为高频考点,正确判断各个电极上发生的反应是解本题关键,难点是电极反应式的书写,知道金属的活泼性强弱与冶炼方法的关系,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生铁是混合物,钢是纯净物 | |
| B. | 用铁矿石来炼铁时,要加入如焦炭等氧化剂 | |
| C. | 不锈钢是铁和硅的合金,比纯铁硬度大,不易腐蚀 | |
| D. | 钢比生铁含碳量低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2O | B. | NO | C. | NO2 | D. | N2O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
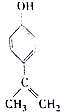
| A. | 该物质的分子式是C9H11O | |
| B. | 该物质分子中的所有C原子可以共面 | |
| C. | 滴入KMnO4(H+)溶液,可观察到紫色褪去,能证明结构中存在碳碳双键 | |
| D. | 1mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别是3mol、4mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com