
分析 ①反应生成碳酸钙、碳酸氢钠、水;
②发生氧化还原反应生成硫酸亚铁、HCl;
③发生氧化还原反应生成Na2FeO4;
④相互促进水解生成沉淀和气体;
⑤向Ba(OH)2溶液中逐滴加入明矾溶液,至生成沉淀的物质的量最大时应是铝离子恰好沉淀.
解答 解:①NaOH溶液和过量的Ca(HCO3)2溶液混合的离子反应为HCO3-+Ca2++OH-═CaCO3↓+H2O,故答案为:HCO3-+Ca2++OH-═CaCO3↓+H2O;
②将SO2通入FeCl3溶液中的离子反应为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
③在强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4的离子反应为2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O,
故答案为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O;
④AlCl3溶液与Na2CO3溶液混合的离子反应为2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑,故答案为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;
⑤向明矾溶液中加入Ba(OH)2溶液至沉淀的物质的量最大的离子方程式为2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓,
故答案为:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重水解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过溴的CCl4溶液中洗气 | B. | 通过酸性KMnO4溶液中洗气 | ||
| C. | 通过溴的水溶液中洗气 | D. | 在Ni催化下,通入H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 发生的主要反应 | |
| 电弧炉 | SiO2+2C$\frac{\underline{\;1600-1800℃\;}}{\;}$Si+2CO↑ |
| 流化床反应器 | Si+3HCl$\frac{\underline{\;250-300\;}}{\;}$SiHCl3+H2 |
| 还原炉 |
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/°C | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇是一种无色无味的液体,可以与水以任意比例互溶 | |
| B. | 1mol乙醇中含有共价键的数目是7NA(NA表示阿伏伽德罗常数的值) | |
| C. | 乙醇与乙二醇、丙三醇互为同系物 | |
| D. | 乙醇可以直接被氧化为乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 B
B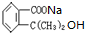
 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ +nH2O;反应类型:缩聚反应
+nH2O;反应类型:缩聚反应 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O;反应类型:消去反应
+H2O;反应类型:消去反应 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ ;反应类型:加聚反应.
;反应类型:加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ②④⑤ | C. | ①②⑤ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水果、蔬菜 | B. | 米饭、面条 | C. | 瘦肉、鸡蛋 | D. | 奶油、牛油 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com