
【题目】Na2O2是重要的化工原料,具有多种用途。
(1)写出CO2和Na2O2反应的化学方程式:___________________________________。
(2)某学生判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断合理吗?__________,简要说明理由:_______________________________________________。
(3)该同学无法断定反应中是否有氧气生成,拟使用如图所示装置进行实验(图中铁架台等装置已略去)。
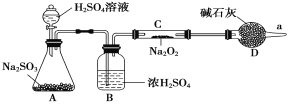
装置中B的作用是_________________,D的作用是_____________________。
(4)将足量的Na2O2投入到含有下列离子的溶液中:NO3-、S2-、HCO3-、CO32-、Na+,设反应完毕后,无固体析出,则上述离子数目减少的有__________,数目增多的离子有________。
【答案】2CO2+2Na2O2=2Na2CO3+O2 合理 由于过氧化钠具有强氧化性,能将+4价的硫氧化为+6价的硫而生成硫酸钠 干燥SO2气体,防止水蒸气进入C装置与Na2O2反应 防止空气中的水蒸气进入C装置与Na2O2反应,同时吸收过量SO2气体,便于氧气的检验和防止污染空气 S2-、HCO3- Na+、CO32-
【解析】
(1)CO2和Na2O2反应生成碳酸钠和氧气,化学方程式2CO2+2Na2O2=2Na2CO3+O2;
(2)SO2有还原性,Na2O2有强氧化性,过氧化钠能将+4价的硫氧化为+6价的硫而生成硫酸钠,所以判断合理。
(3)浓硫酸有吸水性,能吸收二氧化硫中的水分,防止水蒸气与过氧化钠反应而干扰二氧化硫;碱石灰是干燥剂,能吸收水分,防止水蒸气的干扰;碱石灰是碱性物质,能吸收二氧化硫等酸性气体,防止污染大气。
(4)Na2O2具有强氧化性,可与S2-发生氧化还原反应,则S2-数目减小,Na2O2与水反应生成NaOH可与HCO3反应,则溶液中HCO3浓度减小,CO32浓度增大,Na+的数目增多。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 按系统命名法,化合物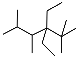 的名称是2,3,5,5-四甲基-4,4-二乙基己烷
的名称是2,3,5,5-四甲基-4,4-二乙基己烷
B. 等物质的量的苯与苯甲酸完全燃烧消耗氧气的量不相等
C. 苯不能使酸性KMnO4溶液褪色,但苯的同系物均可以
D. 结构片段为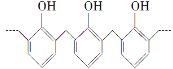 的高聚物,其单体是甲醛和苯酚
的高聚物,其单体是甲醛和苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出前20号元素中的某些元素性质的一些数据:
元素 | A | B | C | D | E | F | G | H | I | J |
原子半径 (10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
最高价态 | +6 | +1 | — | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
最低价态 | -2 | — | -2 | — | -4 | -3 | -1 | — | -3 | -4 |
试回答下列问题:
(1)以上10种元素中第一电离能最小的是____(填编号)。比元素B原子序数大10的元素在元素周期表中的位置:第____周期第____族,其基态原子的核外电子排布式是___________。
(2)由上述C、E、G三种元素中的某两种元素形成的化合物中,每个原子的最外层都满足8电子稳定结构的可能是____(写分子式,写出两种即可),元素G、I分别和J形成的两种化合物的晶体类型分别是_________、___________。
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。 其分子中共形成____个σ键,____个π键。
(4)短周期某主族元素K的电离能情况如图(A)所示。则K元素位于周期表的第_____周期、第____族。
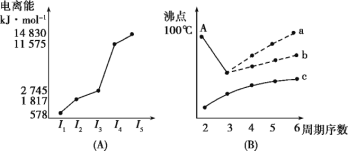
图(B)是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第____族元素氢化物的沸点的变化规律。不同同学对某主族元素的氢化物的沸点变化趋势画出了两条折线——折线a和折线b,你认为正确的是____,理由是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)今有2H2+O2![]() 2H2O反应,构成燃料电池,则负极通的应是________,正极通的应是 ________,电极反应式为__________________、_________________。
2H2O反应,构成燃料电池,则负极通的应是________,正极通的应是 ________,电极反应式为__________________、_________________。
(2)如把H2改为甲烷、H2SO4作导电物质,则电极反应式为:________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z为地壳中含量最高的金属元素。下列说法正确的是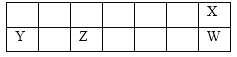
A. 工业上电解YW饱和溶液冶炼金属Y
B. 气态氢化物的稳定性:W > X
C. 简单离子半径的大小顺序:r(Y+)>r(X—)
D. Y、W的最高价氧化物的水化物均能溶解金属Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 稀醋酸中加入少量醋酸钠固体能降低醋酸的电离程度
B. 25 ℃时,硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
C. CaCO3的水溶液导电性很弱,但CaCO3是强电解质
D. 如果盐酸的浓度是醋酸浓度的二倍,则盐酸的H+浓度也是醋酸的二倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在FeCl3和CuCl2的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示。则该溶液中FeCl3与CuCl2的物质的量浓度之比为

A. 3∶1 B. 1∶2 C. 2∶1 D. 1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有OH-、CO32-、A1O2-、SiO32-、SO42-、HCO3-、Na+、Fe3+、Mg2+、Al3+等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化如下图所示。下列说法正确的是

A. 原溶液中可能含有Na2SO4、可能不含有CO32-
B. 原溶液中一定含有的阴离子只有:OH-、A1O2-、CO32-
C. 原溶液中含CO32-与A1O2-的物质的量之比为3:4
D. a-d>3/4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)CH2=CH C(CH3) =CH2系统命名为:____________________________。
(2)除去乙烷中少量的乙烯:____________________________。
(3)写出“间甲基苯乙烯”的结构简式 :____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com