
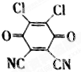
 已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.
已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ?mol-1 | 786 | 715 | 3401 |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
| 4m |
| ρ(a×10-10)3 |
| 4m |
| ρ(a×10-10)3 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| B、蒸馏时,温度计水银球应浸没在液体中 |
| C、蒸馏中,冷却水应从冷凝管的下口通入,上口流出 |
| D、当蒸发到剩有少量液体时,停止加热,利用余热将液体蒸干 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加水振荡后用分液漏斗分离 |
| B、加稀盐酸振荡后用分液漏斗分离 |
| C、加氢氧化钠溶后用分液漏斗分离 |
| D、加溴水振荡后滤去白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu2+、Ba2+、Ag+ |
| B、Ag+、Ba2+、Fe3+ |
| C、Ag+、Ba2+、Mg2+ |
| D、Fe2+、K+、Ba2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com