
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| n(A) | 2.00 | 1.90 | 1.82 | 1.76 | 1.64 | 1.54 | 1.50 | 1.50 | 1.50 |
| n(B) | 1.00 | 0.95 | 0.91 | 0.88 | 0.82 | 0.77 | 0.75 | 0.75 | 0.75 |
| n(C) | 0 | 0.10 | 0.18 | 0.24 | 0.36 | 0.46 | 0.50 | 0.50 | 0.50 |

分析 (1)依据图1可知反应物能量高于生成物,反应是放热反应;
(2)化学平衡状态是正逆反应速率相同,个组分含量保持不变,及其衍生的变量不变分析判断;
(3)根据三行式计算反应进行到1min时的各组分的物质的量.
解答 解:(1)图1可知反应物能量高于生成物,反应是放热反应,△H<0;
故答案为:<;
(2)2A(g)+B(g)=2C(g),反应是气体体积减小的放热反应;
A.反应前后气体质量不变,体积是可变的容器,气体密度不再改变,故A正确;
B.A的物质的量浓度不变是平衡标志,故B正确;
C.放出或吸收的热量不再变化,说明反应达到平衡状态,故C正确;
D.反应是可逆反应,达到平衡状态正逆反应速率相同但不为0,v正(A)=v逆(A)≠0,故D错误;
故答案为:D.
(3)①图象可知C的平衡浓度为0.1mol/L,
2A(g)+B(g)?2C(g)
起始量(mol) 0.4 0.6 0
变化量(mol) 0.1 0.05 0.1
末态量(mol) 0.3 0.55 0.1
反应进行到1分钟时B物质的量为0.55mol,故答案为:0.55mol.
点评 本题考查了化学平衡的影响因素分析,平衡常数和数据分析计算应用,主要是概念理解分析和图象的绘制,掌握基础是关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 运用水玻璃堵塞管道,是因为水玻璃显碱性 | |
| B. | 配制碘水时,常加入少量的KI,目的是防止I2被还原 | |
| C. | 用酸化的高锰酸钾与H2O2可制取少量氧气,KMnO4作催化剂 | |
| D. | 明矾[KAl(SO4)2•12H2O]净水和液氯(Cl2)净水的原理不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,加热溶解, 冷却、过滤 | 得到白色晶体和无色溶液 | |
| ② | 取少量滤液于试管中,滴入适量的硝酸酸化的AgNO3溶液 | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,加热使其熔化,测其熔点 | 熔点为122.4℃ | 白色晶体是苯甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
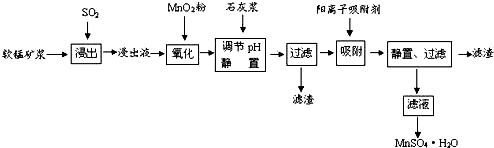

| 离子 | 离子半径(pm) | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO | |
| B. | NH4HSO3溶液与足量的NaOH溶液混合加热:NH4++HSO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+SO32-+2H2O | |
| C. | MnO2与浓盐酸制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| D. | AlCl3溶液中加入过量的氨水:Al3++4NH3•H2O=AlO2-+4NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com