
随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如图)。下列有关说法中正确的是 ( )

A.电解法合成氨的电解池中能用水作电解质溶液的溶剂
B.钯电极B连接的是电源的负极
C.钯电极A的电极反应式为:N2+6e—+6H+==2NH3
D.当有0.3mol电子转移时,有2.688L NH3生成
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:2013-2014浙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100mL 4.40 mol/L盐酸中,充分反应后产生896 mL H2(标准状况),残留固体1.28g。过滤,滤液中无Cu2+。将滤液加水稀释到200mL,测得其中c(H+)为0.400mol/L。则原混合物中单质铁的质量是
A.2.24g B.3.36g C.5.60g D.10.08g
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省宁波市高一下学期期末考试化学试卷(解析版) 题型:填空题
按要求填空:
(1)原子种类由 决定;第三周期半径最小的元素形成的简单离子的离子结构示意图是 ;
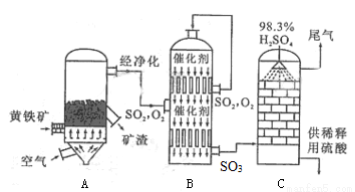
(2)以黄铁矿为原料生产硫酸的工艺流程如下左图所示,设备B的名称为 ;设备A中发生反应的化学方程式 ;
(3)如下右图是实验室中常用于测定盐酸和氢氧化钠溶液反应热的装置,此装置名称叫 ;
(4)0.5 mol CH3OH(l)完全燃烧生成二氧化碳气体和液态水时放出热量为363.2 kJ,写出表示CH3OH(l)燃烧热的热化学方程式 。

查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省宁波市高一下学期期末考试化学试卷(解析版) 题型:选择题
对于化学反应3W(g)+2X(g)===4Y(g)+3Z (g),下列反应速率关系中,正确的是( )
A.v(W)=3v(Z) B.2v(X)=3v(Z) C.2v(X)=v(Y) D.3v(W)=2v(X)
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省台州市路桥区高考理综化学模拟试卷二试卷(解析版) 题型:实验题
A、B、C、D、E为原子序数依次增大的5种短周期元素,A最外层电子数是其电子层数的两倍;B能形成双原子阴离子;C与B能形成两种常见的离子化合物,B、E同主族,C、D、E的最高价氧化物对应的水化物之间两两皆能反应生成盐和水。请回答下列问题:
(1)B的双原子阴离子电子式为 :用化学式表示一种由B、C、E组成的物质 。
(2)B的氢化物比E的氢化物的沸点 (填“高”或“低”),理由是 。
(3)B、C、D组成化合物的水溶液与过量AB2反应的离子方程式 。
(4)已知X是由上述五种元素中的两种组成的离子化合物,其离子具有相同的电子层结构,气体甲是天然气的主要成分。

i .写出反应①的化学方程式 。
ii.若红色固体乙是一种单质,写出反应③的化学方稈式 。
(5)若某气体含有AB2和EB2中的一种或两种,请设计实验方案,探究该气体的成分 。
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省台州市路桥区高考理综化学模拟试卷一试卷(解析版) 题型:填空题
(15分)氨是最重要的化工产品之一。
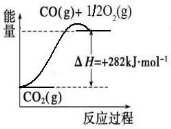
(1)合成氨用的氢气可以甲烷为原料制得:CH4(g)+H2O(g)  CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。
CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。


(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为:[Cu(NH3)2CH3COO] (l)+CO(g)+NH3(g) [Cu(NH3)3] CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 。
[Cu(NH3)3] CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 。
(填写选项编号)
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g) △H<0
CO(NH2)2(l)+H2O(g) △H<0
某温度下,向容积为100L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40 s时达到平衡,此时CO2的转化率为50%。该温度下此反应平衡常数K的值为_________。下图中的曲线表示该反应在前25 s内的反应进程中的NH3浓度变化。若反应延续至70s,保持其它条件不变情况下,请在图中用实线画出使用催化剂时该反应的进程曲线。

(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵。已知弱电解质在水中的电离平衡常数(25℃)如下表:
弱电解质 | H2CO3 | NH3·H2O |
电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
现有常温下0.1 mol·L-1的(NH4)2CO3溶液,
①你认为该溶液呈 性(填“酸”、“中”、“碱”),原因是 。
②就该溶液中粒子之间有下列关系式,你认为其中正确的是 。
A.c (NH4+)>c (CO32-)>c (HCO3-)>c (NH3·H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c (CO32-) + c (HCO3-) +c (H2CO3)=0.1 mol·L-1
D.c (NH4+)+ c (NH3·H2O)=2 c (CO32-) + 2c (HCO3-) +2 c (H2CO3)
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省台州市路桥区高考理综化学模拟试卷一试卷(解析版) 题型:选择题
下列说法不正确的是
A、制摩尔盐时用酒精洗涤产品,制阿司匹林时用冷水洗涤产品
B、培养明矾晶体时,为得到较大颗粒的晶体,应自然冷却,并静置过夜
C、铁钉镀锌前,先要用砂纸打磨直至表面变得光滑,然后放入氢氧化钠溶液中浸泡5分钟,用水洗净后还需放入稀盐酸中浸泡,再用水洗净
D、做“食醋总酸含量的测定”实验时,必须先将市售食醋稀释10倍,然后用洗净的酸式滴定管量取一定体积的稀释液于洁净的锥形瓶中,锥形瓶不需要先用醋酸溶液润洗
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省下学期第二次统练高二化学试卷(解析版) 题型:选择题
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是
A.第一电离能:③>②>① B.原子半径:③>②>①
C.电负性:③>②>① D.最高正化合价:③>②>①
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省五校高三第二次联考理综化学试卷(解析版) 题型:填空题
硫酸亚铁是一种重要的化工原料,可以制备一系列物质。下列说法错误的是( )

A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com