
【题目】下列物质属于有机物的是( )
A.Na2CO3 B.CH4 C.KSCN D.CO2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.合成氨反应中为了提高正反应速率,及时抽走氨气
B.SO2催化氧化中通入过量空气可提高SO2的平衡转化率
C.合成氨中加入催化剂可提高氮气的平衡转化率
D.合成氨反应中缩小容器体积可以使平衡正向移动,所以氮气浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的废金属屑的主要成分为铝、铁和铜,某化学兴趣小组在学习了元素及其化合物的相关知识后,设计了如图1实验流程,用该工厂的金属废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O)。
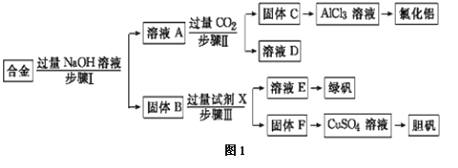
请回答:
(1)写出步骤Ⅱ反应的离子方程式: 。
(2)步骤Ⅰ、Ⅱ、Ⅲ进行的实验操作中均需用到的玻璃仪器有 。
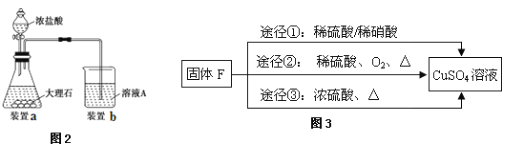
(3)进行步骤Ⅱ时,该小组用如图2所示装置及试剂制取CO2并将制得的气体通入溶液A中一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少,原因是 。
(4)从溶液E得到绿矾晶体的实验操作是 。
(5)用固体F制备CuSO4溶液,可设计如图3三种途径:
写出途径③中反应的化学方程式: ,用途径①制备CuSO4溶液时,混酸中硫酸和硝酸的最佳物质的量之比为 。
(6)用惰性电极电解硫酸铜溶液一段时间后,阴极增重3.2g。请写出阳极电极反应式 ,阳极产生 L气体(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中含有相同的化学键类型的是
A. NaCl、HCl、H2O、NaOH B. Cl2、Na2S、HCl、SO2
C. Na2O2、H2O2、H2O、O3 D. HBr、CO2、H2O、CS2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是化学对人类的一项重大贡献。
(1)某兴趣小组为研究原电池原理,设计如图装置。

①a和b不连接时,烧杯中发生反应的离子方程式是 ________________________________________。
②a和b用导线连接,Cu极为原电池________极(填“正”或“负”),该电极反应式是_____________________________,溶液中的H+移向________(填“Cu”或“Zn”)极。
③无论a和b是否连接,Zn片均被腐蚀,若转移了0.2 mol电子, 则理论上Zn片质量减轻________g。
(2)如图是甲烷燃料电池原理示意图,回答下列问题:

①电池的负极是________(填“a”或“b”)电极,该极的电极反应式为: _________________________。
②电池工作一段时间后电解质溶液的pH__________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态Cu2+的核外电子排布式为 ,在高温下CuO 能分解生成Cu2O,试从原子结构角度解释其原因: 。根据元素原子的外围电子排布特征,可将周期表分成五个区域,元素Cu属于 区。
(2)下列叙述不正确的是 。(填字母)
a.HCHO和CO2分子中的中心原子均采用sp杂化
b.因为HCHO与水分子间能形成氢键,所以HCHO易溶于水
c.C6H6分子中含有6个σ键和1个大π键,C2H2是非极性分子
d.CO2晶体的熔点、沸点都比二氧化硅晶体的低,原因是CO2为分子晶体而二氧化硅是原子晶体
(3)氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 。其中的C的杂化类型为 ,写出一种与 CN— 互为等电子体的单质分子式 。
(4)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
① 与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 。
② 六氰合亚铁离子[Fe(CN)6]4 -中不存在 。
a.共价键
b.非极性键
c.配位键
d.σ键
e.π键
(5)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,其晶胞结构与金刚石类似,一个该晶胞中含有 个氮原子, 个硼原子,设氮原子半径为a pm,硼的原子半径b pm ,求该晶胞的空间利用率 。(用含a、b的代数式表示)
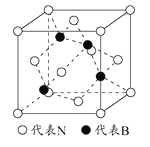
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年8月12日23:30左右,天津滨海新区某公司仓库发生爆炸,事发仓库里存放了大量的硝酸铵、氰化钠(NaCN)和金属钠等危险化学品。
(1)钠在周期表中的位置是 ,实验室少量的钠保存于 中。
(2)NaCN的电子式是 。
(3)氰化钠是一种重要的化工原料,也是剧毒危险品,皮肤伤口接触、吸入、吞食微量可中毒死亡。氰化钠易溶于水,水溶液呈强碱性。氰化钠泄露可用双氧水或硫代硫酸钠中和。
①用离子方程式表示其水溶液呈强碱性的原因: 。
②用双氧水处理产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,请写出该反应的离子方程式 ;
③用硫代硫酸钠中和的离子方程式为:CN-+S2O32- = A+SO32-,A为 (填化学式)。
④可用纯碱、焦炭、氨气反应制取NaCN,写出反应的化学方程式,并用单线桥标明电子转移的方向和数目 。
(4)CN-中C元素显+2价, N元素显-3价,则非金属性N C(填<、=或>),请用简单的实验方法证明(要求说明简单操作、现象和结论): 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com