
| A、镁、铁 | B、锌、铁 |
| C、铁、铜 | D、镁、钙 |
| V |
| Vm |
| m |
| n |
| 5.6L |
| 22.4L/mol |
. |
| M |
| 11g |
| 0.25mol |


 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
| 反应时间t/h | 0 | 4 | 8 | 16 |
| C(A)/(mol?L-1) | 0.100 | 0.0508 | 0.0254 | 0.00635 |
查看答案和解析>>
科目:高中化学 来源: 题型:
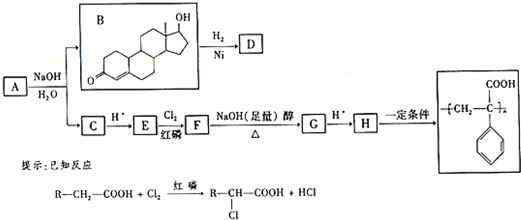
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、产物乙酸乙酯存在18O |
| B、产物水中存在18O |
| C、反应中加入浓硫酸作催化剂 |
| D、此反应属于取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
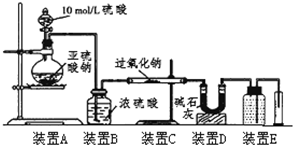 某校化学兴趣小组在学习了过氧化钠性质后,进一步研究其与SO2反应情况,查阅相关资料知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成.有同学认为:CO2、SO2虽然都是酸性氧化物,但SO2具有较强的还原性,CO2无还原性,反应原理应该不相同,并设计如下实验进行探究.
某校化学兴趣小组在学习了过氧化钠性质后,进一步研究其与SO2反应情况,查阅相关资料知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成.有同学认为:CO2、SO2虽然都是酸性氧化物,但SO2具有较强的还原性,CO2无还原性,反应原理应该不相同,并设计如下实验进行探究.| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取反应后的固体放入试管中,… |
| SO2被氧化的程度 | V与m1或m2的关系 |
| 完全被氧化 | V=0 |
| 部分被氧化 | |
| 未被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、30% | B、35% |
| C、65% | D、70% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、天然气是以甲烷为主要成分的高效清洁燃料 |
| B、煤的干馏可得到煤焦油,通过煤焦油的分馏可获得各种芳香烃 |
| C、石油中含有烷烃和环烷烃,因此由石油不可能获得芳香烃 |
| D、通过石油的催化裂化及裂解可以得到轻质油和气态烯烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com