
 (1)8.4g N2与9.6g某单质Rx所含原子个数相同,且分子数之比为3:2,则R的相对原子质量是16,x值为3.
(1)8.4g N2与9.6g某单质Rx所含原子个数相同,且分子数之比为3:2,则R的相对原子质量是16,x值为3.分析 (1)先根据分子数之比为3:2,则N2与RX相对分子质量之比$\frac{8.4}{3}$:$\frac{9.6}{2}$=7:12,利用N2相对分子质量求出Rx相对分子质量,再根据分子数目、分子组成与原子数目之间的关系求出x和R的相对原子质量;
(2)依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$结合水、硫酸分子结构组成解答;
(3)反应前,左右两室的体积之比为1:3,则左右两室中气体物质的量之比为1:3,反应后,活塞处于中央,两室体积相等,则两室中气体的物质的量相等,令空气的物质的量为1mol,设H2、O2的物质的量分别为xmol、ymol,讨论氢气或氧气过量计算解答.
解答 解:(1)n(N2)=$\frac{8.4g}{28g/mol}$=0.3mol,N原子的物质的量为0.6mol,8.4gN2与9.6g某单质R所含的原子个数相同,则9.6g某单质Rx中所含原子个数为0.6NA,
分子数之比为3:2,所以N2与RX相对分子质量之比$\frac{8.4}{3}$:$\frac{9.6}{2}$=7:12,
而N2相对分子质量为28,所以Rx相对分子质量=28×$\frac{12}{7}$=48,
又因为两者所含原子个数相同,即3×2=2x,
得x=3,
所以R的相对原子质量=$\frac{48}{3}$=16,
故答案为:16;3;
(2)水与硫酸分子数相等,则二者物质的量相等:$\frac{4.5}{18}$=$\frac{m({H}_{2}S{O}_{4})}{98}$=0.25mol,解得m(H2SO4)=24.5g;
含有氧原子数之比为:0.25mol×1:0.25mol×4=1:4;含有氢原子数之比为:0.25mol×2:0.25mol×2=1:1;
故答案为:24.5;1:4;1:1;
(3)令空气的物质的量为1mol,反应前,左右两室的体积之比为1:3,反应前右室的物质的量为3mol,反应后,活塞处于中央,两室体积相等,则两室中气体的物质的量相等,反应后右室气体物质的量为1mol,发生反应2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,
设H2、O2的物质的量分别为xmol、ymol,
若氢气过量,则:x-2y=1,x+y=3,解得x:y=7:2,
若氧气过量,则:y-0.5x=1,x+y=3,解得x:y=4:5,
故答案为:7:2 或4:5.
点评 本题考查物质的量有关计算,为高频考点,侧重于学生的分析、计算能力的考查,难度不大,注意掌握相对分子质量的计算方法.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:选择题
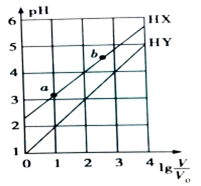 常温下,浓度均为0.1mol•L-1、体积均为V0的HX和HY溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示(不考虑HX、HY和H2O的挥发),下列叙述正确的是( )
常温下,浓度均为0.1mol•L-1、体积均为V0的HX和HY溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示(不考虑HX、HY和H2O的挥发),下列叙述正确的是( )| A. | HX和HY都是弱酸,且HX的酸性比HY的弱 | |
| B. | HX的电离程度:a点大于b点 | |
| C. | HX溶液由a点稀释至b点时,由水电离出的c(H+)•c(OH-)不变 | |
| D. | 当lg$\frac{V}{{V}_{0}}$=3时,若两溶液同时升高温度,则$\frac{c({X}^{-})}{c({Y}^{-})}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 乙二醇( C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、Cl-、OH- | B. | H+、Na+、CO32-、NO3- | ||
| C. | Cu2+、K+、SO42-、NO3- | D. | Na+、H+、OH-、Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯锌与稀硫酸反应时,加少量CuSO4溶液,可使反应速率加快 | |
| B. | 甲烷和氧气以及KOH溶液构成的新型燃料电池中,负极上发生的反应为CH4+8OH-+8e-═CO2+6H2O | |
| C. | 把铜片和铁片紧靠在一起浸入稀H2SO4中,铁片表面出现气泡 | |
| D. | 把铜片插入FeCl3溶液中,在铜片表面出现一层铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①③ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com