
【题目】![]() 时,下列有关电解质溶液说法正确的是
时,下列有关电解质溶液说法正确的是![]()
![]()
A.稀醋酸中加入冰醋酸,醋酸电离平衡右移,电离度增大
B.向NaF溶液中滴加硫酸至中性时,![]()
C.向氨水中加入![]() 固体,溶液中
固体,溶液中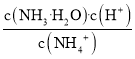 增大
增大
D.AgCl在水和NaCl溶液中的溶度积分别为![]() 、
、![]() ,则
,则![]()
【答案】B
【解析】
A.稀醋酸中加入冰醋酸,醋酸电离平衡右移,但电离度减小,故A错误;
B.向NaF溶液中滴加硫酸至中性时,溶液中物料守恒为:c(Na+)=c(HF)+c(F-),电荷守恒为c(Na+)+c(H+)=c(OH-)+c(F-)+2c(SO42-),消去钠离子的浓度可得:c(HF)+c(H+)=c(OH-)+2c(SO42-),溶液显中性,则c(H+)=c(OH-),所以c(HF)=2c(SO42-),则c(SO42-)<c(HF),故B正确;
C.铵根离子的水解常数Kh=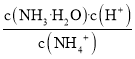 ,溶液的温度不变,水解常数不变,故C错误;
,溶液的温度不变,水解常数不变,故C错误;
D.溶度积只与温度有关,与溶液的浓度无关,所以AgCl在水和NaCl溶液中的溶度积分别为K1、K2,则K1=K2,故D错误;
故答案为B。


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】某同学组装了如图所示的电化学装置,则下列说法正确的是( )

A.图中甲池为原电池装置,Cu电极发生还原反应
B.实验过程中,甲池左侧烧杯中NO3-的浓度不变
C.若甲池中Ag电极质量增加5.4g时,乙池某电极析出1.6g金属,则乙中的某盐溶液可能是AgNO3溶液
D.若用铜制U形物代替“盐桥”,工作一段时间后取出U型物称量,质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,一家瑞典公司发明了一种新型充电器“![]() ”,仅仅需要一勺水,它便可以产生维持10小时手机使用的电量。其反应原理为
”,仅仅需要一勺水,它便可以产生维持10小时手机使用的电量。其反应原理为![]() ,则下列说法错误的是
,则下列说法错误的是
A.该电池可用Al作电极材料
B.![]() 在电池的负极发生氧化反应,生成
在电池的负极发生氧化反应,生成![]()
C.电池正极发生的反应为![]()
D.当电池转移0.2mol电子时,可生成标准状况下2.24LH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。

(1)A是铅蓄电池的___________极,铅蓄电池正极反应式为___________,放电过程中电解液的密度___________ (填“减小”、“增大”或“不变”)。
(2)Ag电极的电极反应式是___________,该电极的电极产物共____________g。
(3)Cu电极的电极反应式是____________,CuSO4溶液的浓度____________(填“减小”、“增大”或“不变”)
(4)如图表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示___________。

a.各U形管中产生的气体的体积
b.各U形管中阳极质量的减少量
c.各U形管中阴极质量的增加量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的是
A.制备![]() 胶体:向饱和氯化铁溶液中滴加氨水
胶体:向饱和氯化铁溶液中滴加氨水
B.除去![]() 溶液中的少量
溶液中的少量![]() :加入足量铁屑,充分反应后,过滤
:加入足量铁屑,充分反应后,过滤
C.检验食盐中是否含有![]() :取少量食盐溶液,加稀硫酸酸化,再滴入淀粉溶液,观察实验现象
:取少量食盐溶液,加稀硫酸酸化,再滴入淀粉溶液,观察实验现象
D.证明在相同温度下![]() :向
:向![]()
![]() 溶液中滴入2滴
溶液中滴入2滴![]()
![]() 溶液,产生白色沉淀后,再滴加2滴
溶液,产生白色沉淀后,再滴加2滴![]()
![]()
![]() 溶液,观察现象
溶液,观察现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在0.2mol/LAlCl3溶液中,逐滴加入1.0mol/LNaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法正确的( )

A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3OH-=Al(OH)3
B.b点水的电离程度小于a点
C.通过曲线变化,可估计Al(OH)3的溶度积约为1×10-20
D.d点时,溶液中已无沉淀剩余
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 取1mL20%蔗糖溶液,加入适量稀硫酸,水浴加热后取少量溶液,加入几滴新制的Cu(OH)2悬浊液,加热没有砖红色沉淀生成 | 溶液中未出现砖红沉淀 | 蔗糖未水解 |
B | 将C和SiO2的固体混合物加热加热 | 2C+SiO2 | 非金属性:C>Si |
C | 向盛有2mL0.1molL-1的NaCl溶液的试管中逐滴加入几滴0.1molL-1AgNO3溶液,充分反应后,再逐滴加入AgNO3溶液,充分反应后,再逐滴加入0.1molL-1的KI溶液 | 白色沉淀变为黄色沉淀 | Ksp(AgCl)>Ksp(Agl), |
D | 向待测液中加入适量的稀NaOH溶液,将湿润的蓝色石蕊试纸放在试管口 | 湿润的蓝色石蕊试纸未变红 | 待测液中不存在NH4+ |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学选修:化学与技术某研究性学习小组对某废旧合金(含有Cu、Fe、Si 三种成分)进行分离、回收.其工业流程如图:

已知:298K时,Ksp[Cu(OH)2]=2.0×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ一定都不含有的操作是________
A.过滤 B.洗涤 C.干燥 D.蒸馏
(2)过量的还原剂应是________,溶液a中发生的反应的离子方程式为________;
(3)若用x mol/L KMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液ymL,则最后所得红棕色固体C的质量为________g(用含x、y的代数式表示).
(4)将溶液c调节pH至2.9-3.2的目的是________;
(5)常温下,取0.2mol/L的CuCl2溶液,若要使Cu2+开始沉淀,应调节pH至________;
(6)工业上由红棕色固体C制取相应单质常用的方法是________
A.电解法 B.热还原法 C.热分解法
(7)用惰性电极电解溶液e制取固体B,所发生的化学反应方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷同为VA族元素,它们的单质和化合物在生产、生活中有广泛应用。回答下列问题:
(1)下列有关氮原子电子排布图中,能量最低和最高的分别为____、___。
a.![]() b.
b.![]()
c.![]() d.
d.![]()
(2)![]() 是一种芳环硝化中间体,其中氮原子的杂化轨道类型为____,与
是一种芳环硝化中间体,其中氮原子的杂化轨道类型为____,与![]() 互为等电子体的化合物分子是___(任写一种,填化学式)。
互为等电子体的化合物分子是___(任写一种,填化学式)。
(3)C、N、O是第二周期相邻的三种非金属元素,它们的第一电离能由大到小的顺序为____;NH3是一种极易溶于水的气体,其沸点比AsH3的沸点______(填“低”或“高”),其原因是______。
(4)砷是制造新型半导体的材料,同时砷的化合物又具有较强的毒性。
1918年美国人通过反应:HC≡CH+AsCl3![]() CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为___;AsCl3分子的空间构型为_____。
CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为___;AsCl3分子的空间构型为_____。
(5)2018年7月《Science》报道,BingLv等通过反应:4BI3+As4![]() 4BAs+6I2合成了具有极高导热性的半导体新材料BAs。BAs晶胞结构如图所示:
4BAs+6I2合成了具有极高导热性的半导体新材料BAs。BAs晶胞结构如图所示:
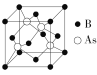
已知该晶胞参数为a pm,NA表示阿伏加德罗常数,则该晶胞的密度ρ=_____g·cm3(用代数式表示,可不必化简)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com