
下列表示对应化学反应的离子方程式正确的是( )
|
| A. | 用白醋除铁锈:Fe2O3+6H+═3H2O+2Fe3+ |
|
| B. | 向NH4HCO3溶液中加入过量的Ba(OH)2溶液并加热:Ba2++2OH﹣+NH4++HCO3+ |
|
| C. | 用过量冷氨水吸收SO2:SO2+NH3•H2O═HSO3﹣+NH4+ |
|
| D. | 用强碱吸收工业制取硝酸尾气:NO+NO2+2OH﹣═2NO3﹣+H2O |
| 离子方程式的书写. | |
| 专题: | 离子反应专题. |
| 分析: | A.醋酸为弱酸,在离子反应中应保留化学式; B.NH4HCO3溶液中加入过量的Ba(OH)2溶液并加热,二者以1:1反应,反应生成碳酸酸钡、水、氨气; C.用过量冷氨水吸收SO2生成亚硫酸铵; D.用强碱吸收工业制取硝酸尾气的反应:NO+NO2+2NaOH=2NaNO2+H2O. |
| 解答: | 解:A.用白醋除铁锈:Fe2O3+6CH3COOH═3H2O+6CH3COO﹣+2Fe3+,故A错误; B.NH4HCO3溶液中加入过量的Ba(OH)2溶液并加热,二者以1:1反应:Ba2++2OH﹣+N C.用过量冷氨水吸收SO2生成亚硫酸铵:SO2+2NH3•H2O═S032﹣+2N D.用强碱吸收工业制取硝酸尾气的反应:NO+NO2+2OH﹣=2NO2﹣+H2O,故D错误; 故选B. |
| 点评: | 本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,题目难度不大,注意与量有关的离子反应中量少的物质完全反应. |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
有关晶体的叙述中正确的是( )
A.在SiO2晶体中,由Si、O构成的最小单元环中共有8个原子
B.在28 g晶体硅中,含Si—Si共价键个数为4NA
C.金刚石的熔沸点高于晶体硅,是因为C—C键键能小于Si—Si键
D.镁型和铜型金属晶体的配位数均为12
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X和Y是两种单质,X+Y→X2++Y2﹣,现有下列叙述正确的是:①X被氧化,②X是氧化剂,③Y2﹣是还原产物,④X2+具有氧化性,⑤Y2﹣具有还原性,⑥Y单质氧化性比X2+氧化性强( )
|
| A. | ①②③ | B. | ①②⑥ | C. | ①③④⑤⑥ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:HNCO(异氰酸,其结构是H﹣N=C=O)能和NO2反应生成N2、CO2和H2O.下列有关上述反应的叙述不正确的是( )
|
| A. | HNCO中的氮元素被氧化 | B. | NO2中的氮元素被还原 |
|
| C. | 每生成1mol H2O转移6mol电子 | D. | CO2是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有FeO、Fe2O3的混合物若干克,在足量H2气流中,加热充分反应,冷却后称得剩余固体比原混合物减轻0.8g;将等质量的原混合物与盐酸反应,欲使之完全溶解,需1mol•L﹣1的盐酸的体积至少为( )
|
| A. | 0.05 L | B. | 0.1 L | C. | 0.2 L | D. | 1 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
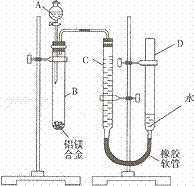
某学习小组用如图装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
(1)A中试剂为 .
(2)实验前,先将铝镁合金在稀硝酸中浸泡片刻,其目的是 .
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤、洗涤、干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂;⑤检查气密性.上述操作的顺序是 (填序号);记录C的液面位置时,除视线平视外,还应 .
(4)B中发生反应的化学方程式为 .
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL (已换算为标准状况),B中剩余固体质量为c g,则铝的相对原子质量为 .
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将 (填“偏大”、“偏小”、“不受影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
医用化学杂志报道,用聚乙交酯纤维材料C制作的缝合线比天然高分子材料的肠线为好。它的合成过程如下:
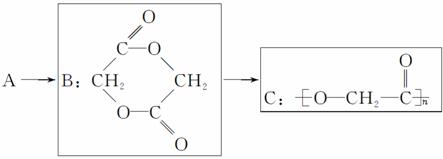
(1)写出A的结构简式:__________________。
(2)写出A制取B的化学方程式:_________________。
(3)也可以由A直接制备C,则A→C直接制备的化学方程式为____________,其反应类型为________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64)。
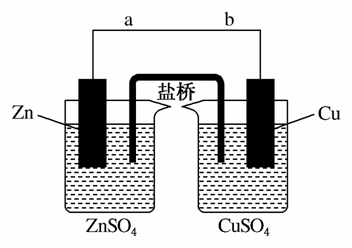
按照实验步骤依次回答下列问题:
(1)导线中电子流向为__________(用a、b表示);
(2)写出装置中镀锌电极上的电极反应式:_______________;
(3)若装置中铜电极的质量增加0.64 g,则导线中转移的电子数目为__________;(不许用“NA”表示);
(4)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向向表述正确的是__________。
A.盐桥中的K+向左侧烧杯移动、Cl-向右烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左烧杯移动
C.盐桥中的K+、Cl-都向左侧烧杯移动
D.盐桥中的K+、Cl-几乎不移动
(5)若ZnSO4溶液中含有杂质Cu2+,会加速Zn电极的腐蚀,还可能导致电流在较短时间内衰减。欲除去Cu2+,最好选用下列试剂中的__________(填代号)。
A.NaOH B.Zn
C.Fe D.H2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com