
| A. | 防止氯气通过漏斗扩散到空气中造成污染 | |
| B. | 便于控制加入浓盐酸的量 | |
| C. | 因长颈漏斗加热时容易破裂 | |
| D. | 尽量避免HC1挥发到空气中 |
分析 实验室制备氯气的原理:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,反应物浓盐酸具有易挥发性,容易引起空气污染,且氯化氢利用率低,用分液漏斗可以控制加入浓盐酸的量,避免浓盐酸的挥发,防止生成的氯气扩散造成污染,据此解答.
解答 解:实验室制备氯气的原理:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,反应物浓盐酸具有易挥发性,容易引起空气污染,且氯化氢利用率低,用分液漏斗可以控制加入浓盐酸的量,避免浓盐酸的挥发,防止生成的氯气扩散造成污染,不是因为长颈漏斗加热时容易破裂;
故选:C.
点评 本题考查了实验室制备氯气,熟悉氯气制备原理,明确原料浓盐酸的挥发性是解题关键,题目难度不大.


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:填空题
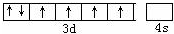 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn2++2OH-═Zn(OH)2↓ ZnCO3+2NaOH═Zn(OH)2↓+Na2CO3 | |
| B. | Ba2++SO42-═BaSO4↓ Ba(OH)2+H2SO4═BaSO4↓+2H2O | |
| C. | Ag++Cl-═AgCl↓ AgNO3+NaCl═AgCl↓+NaNO3 | |
| D. | Cu+2Ag+═Cu2++2Ag↓ Cu+2AgCl═2Ag+CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:Fe(OH)3和Al(OH)3沉淀的生成与溶解的pH如表:
已知:Fe(OH)3和Al(OH)3沉淀的生成与溶解的pH如表:| 氢氧化物 | 溶液pH | |||
| 开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 | |
| Fe(OH)3 | 2.3 | 3.4 | - | - |
| Al(OH)3 | 3.3 | 5.2 | 7.8 | 12.8 |
| A. | AB段可能发生的反应是:2SO42-+2Ba2++Al3++30H-=2BaSO4↓+Al(OH)3↓ | |
| B. | C点对应的沉淀是:Fe(OH)3和BaSO4 | |
| C. | OA段可能发生的反应是:3Ba2++6OH-+3SO42-+Al3++Fe3+=3BaSO4↓+Fe(OH)3↓+Al(OH)3↓ | |
| D. | 据图计算原溶液中:c(Cl-)=c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com