
【题目】下列物质久置在敞口容器中,溶质质量分数减小,同时溶液质量增加的是( )
A. 澄清石灰水B. 浓硫酸C. 浓盐酸D. 氯化铁溶液
科目:高中化学 来源: 题型:
【题目】一个蛋白质分子由四条肽链组成,364个氨基酸形成,则这个蛋白质分子含有的-COOH和-NH2 数目分别为 ( )
A. 366、366 B. 362、362 C. 4、 4 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A+3B=2C+D在某段时间内以A的浓度变化表示的化学反应速率为2 mol·L-1·s-1,则此段时间内用B的浓度变化表示的化学反应速率为( )。
A.5 mol·L-1·s-1 B.6 mol·L-1·s-1 C.2 mol·L-1·s-1 D.3 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是 ( )
A.N2是大气中的主要成分之一,雷雨时,可直接转化为NO2
B.硝酸不稳定,受热或光照易分解
C.铵盐受热易分解,因此贮存铵态氮肥时要密封保存,并放在阴凉通风处
D.Cl2能与金属活动顺序表中大多数金属反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)某研究小组制备氯气并对产生氯气的条件进行探究。
(1)装置A中用MnO2与浓盐酸反应制取Cl2,利用了浓HCl的______(填“氧化性”或“还原性”)。
(2)A中产生的气体不纯,含有的杂质可能是______。
(3)B用于收集Cl2,请完善装置B并用箭头标明进出气体方向。____________
(4)C用于吸收多余的Cl2,C中发生反应的离子方程式是______。
(5)该小组欲研究盐酸的浓度对制Cl2的影响,设计实验进行如下探究。
实验 | 操作 | 现象 |
I | 常温下将MnO2和12 mol·L-1浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
II | 将I中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
III | 加热MnO2和4 mol·L-1稀盐酸混合物 | 无明显现象 |
①已知MnO2呈弱碱性。I中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是________。
②II中发生了分解反应,反应的化学方程式是________。
③III中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验IV进行探究:
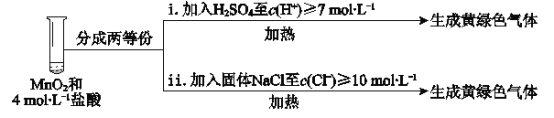
将实验III、IV作对比,得出的结论是________;将i、ii作对比,得出的结论是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙苯是主要的化工产品。某课题组拟制备乙苯:
查阅资料如下:
①几种有机物的沸点如下表:
有机物 | 苯 | 溴乙烷 | 乙苯 |
沸点/℃ | 80 | 38.4 | 136.2 |
②化学原理: ![]() +CH3CH2Br
+CH3CH2Br![]()
![]() +HBr。
+HBr。
③氯化铝易升华、易潮解。
I.制备氯化铝。
甲同学选择下列装置制备氯化铝(装置不可重复使用):

(1)本实验制备氯气的离子方程式为______________。
(2)气体流程方向是从左至右,装置导管接口连接顺序a→_____→k→i→f→g→_____。
(3)D装置存在的明显缺陷是____;改进之后,进行后续实验。
(4)连接装置之后,检查装置的气密性,装药品。先点燃A处酒精灯,当_____时(填实验现象),点燃F处酒精灯。
II.制备乙苯
乙同学设计实验步骤如下:

步骤1:连接装置并检查气密性(如图所示,夹持装置省略)。
步骤2:用酒精灯微热烧瓶。
步骤3:在烧瓶中加入少量无水氯化铝、适量的苯和溴乙烷。
步骤4:加热,充分反应半小时。
步骤5:提纯产品。
回答下列问题:
(5)步骤2“微热”烧瓶的目的是___________。
(6)本实验加热方式宜采用_______。 (填“ 酒精灯直接加热” 或“水浴加热”)。
(7)盛有蒸馏水的B装置中干燥管的作用是______。确认本实验A中已发生了反应的方法是___。
(8)提纯产品的操作步聚有:①过滤;②用稀盐酸洗除;③少量蒸馏水水洗;④加入大量无水氯化钙;⑤用大量水洗;⑥蔡馏并收集136.2℃馏分。先后操作顺序为__________(填代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镓(GaAs)是优良的半导体材料或用于制作微型激光器或太阳能电池的材料等。部分元素在周期表中位置如下:
A1 | Si | P |
Ga | Ge | As |
回答下列问题:
(1)六种元素中,非金属性最强的元素是:________.写出As原子的最外层的电子排布式_________,As原子核外有_____个未成对电子。
(2)根据元素周期律,可判断原子半径Ga_____As。(选填“>”、“<”或“=”)。写出铝的最高价氧化物对应水化物的电离方程式:________________
(3)NH3的分子构型是_______。GaF3的熔点高于1000°C,GaCl3的熔点为77.9°C,可能的原因是_______.写出C2H2的电子式为:_________
(4)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因___________
GeCl4 | GeBr4 | GeI4 | |
熔点/°C | -49.5 | 26 | 146 |
沸点/°C | 83.1 | 186 | 约400 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z 都是金属,把 X 浸入 Z 的硝酸盐溶液中,X 的表面有 Z 析出,X 和 Y 组成原电池时,Y 为电池的负极。X、Y、Z 三种金属的活动性顺序为( )
A.X>Y>ZB.X>Z>YC.Y>X>ZD.Y>Z>X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com