
 4N2(g)+6H2O(g);△H
4N2(g)+6H2O(g);△H| 反应 | △H(kJ•mol-1) | 平衡常数(K) |
| 4NH3 (g)+5O2 (g)?4NO (g)+6H2O (g) | -905.5 | 1.1×1026mol•L-1 |
| 4NH3 (g)+4O2 (g)?2N2O (g)+6H2O (g) | -1104.9 | 4.4×1028 |
| 4NH3 (g)+3O2 (g)?2N2 (g)+6H2O (g) | -1269.0 | 7.1×1034L•mol-1 |
分析 (1)依据副反应的热化学方程式、盖斯定律计算得到主反应的反应焓变,4NH3 (g)+3O2 (g)?2N2 (g)+6H2O (g) K3=7.1×1034L•mol-1,K32=$\frac{{c}^{4}({N}_{2}){c}^{12}({H}_{2}O)}{{c}^{8}(N{H}_{3}){c}^{6}({O}_{2})}$=(7.1×1034L•mol-1 )2;4NH3 (g)+5O2 (g)?4NO (g)+6H2O (g)K1=$\frac{{c}^{4}(NO){c}^{6}({H}_{2}O)}{{c}^{4}(N{H}_{3}){c}^{5}({O}_{2})}$=1.1×1026mol•L-1,则主反应4NH3(g)+4NO(g)+O2(g)$\frac{\underline{\;催化剂\;}}{\;}$4N2(g)+6H2O(g);K=$\frac{{c}^{4}({N}_{2}){c}^{6}({H}_{2}O)}{{c}^{4}(N{H}_{3})c({O}_{2})}$=$\frac{{{K}_{3}}^{2}}{{K}_{1}}$;
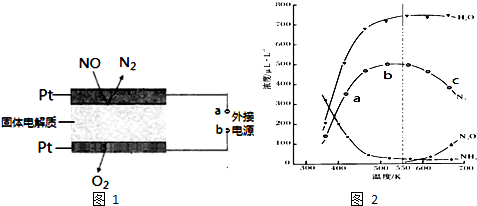
(2)①在密闭体系中进行实验,起始投入一定量NH3、NO、O2,测定不同温度下,在相同时间内各组分的浓度变化,反应速率随温度升高增大;
②N2浓度曲线先上升后下降,是因为反应开始正向进行未达到平衡状态,氮气浓度增大,达到平衡后,反应是放热反应,升温平衡逆向进行,所以氮气浓度减小;
③550K时生成N2O的反应几乎没发生,欲提高N2O的百分含量,应是反应向副反应方向进行4NH3 (g)+4O2 (g)?2N2O (g)+6H2O (g),改变主反应反应历程,可以选择合适的催化剂是副反应发生;
(3)反应原理是利用电解吸收NO生成氮气,氮元素化合价+2价变化为0价,发生还原反应,在电解池的阴极发生还原反应,则a为外接电源的负极,固体电解质起到传导作用的是O2-.
解答 解:(1)依据副反应的热化学方程式结合盖斯定律计算得到主反应的反应焓变,
③4NH3 (g)+3O2 (g)?2N2 (g)+6H2O (g) K3=7.1×1034L•mol-1,
①4NH3 (g)+5O2 (g)?4NO (g)+6H2O (g)K1=1.1×1026mol•L-1,
③×2-①得到主反应4NH3(g)+4NO(g)+O2(g)$\frac{\underline{\;催化剂\;}}{\;}$4N2(g)+6H2O(g)△H=-1632.5KJ/mol,
4NH3 (g)+3O2 (g)?2N2 (g)+6H2O (g) K3=7.1×1034L•mol-1,K32=$\frac{{c}^{4}({N}_{2}){c}^{12}({H}_{2}O)}{{c}^{8}(N{H}_{3}){c}^{6}({O}_{2})}$=(7.1×1034L•mol-1 )2;4NH3 (g)+5O2 (g)?4NO (g)+6H2O (g)K1=$\frac{{c}^{4}(NO){c}^{6}({H}_{2}O)}{{c}^{4}(N{H}_{3}){c}^{5}({O}_{2})}$=1.1×1026mol•L-1,则主反应4NH3(g)+4NO(g)+O2(g)$\frac{\underline{\;催化剂\;}}{\;}$4N2(g)+6H2O(g);K=$\frac{{c}^{4}({N}_{2}){c}^{6}({H}_{2}O)}{{c}^{4}(N{H}_{3})c({O}_{2})}$=$\frac{{{K}_{3}}^{2}}{{K}_{1}}$=$\frac{(7.1×1{0}^{34})^{2}}{1.1×1{0}^{26}}$=4.6×1043L•mol-1,
故答案为:-1632.5;4.6×1043L•mol-1;
(2)①影响化学反应速率的条件中增大浓度、增大压强、升高温度都会增大反应速率,其中温度升高对反应速率的影响大,abc点中c点温度大,反应速率大,
故答案为:c;
②分析图象中氮气的浓度变化可知,550K时达到最大,550K后随温度升高浓度减小,变化趋势说明在b点前反应未达到平衡状态,反应正向进行氮气浓度增大,达到平衡状态后b点后氮气浓度随温度升高减小,说明正反应是放热反应,升温平衡逆向进行,且随温度升高有副产物的生成,N2浓度降低,
故答案为:先上升:反应还未到达平衡状态,温度越高,化学反应速率越快,单位时间内N2浓 度越大;后下降:达到平衡状态后,随着温度升高,因反应正向放热,平衡逆向移动,且随温度升高有副产物的生成,N2浓度降低;
③550K时生成N2O的反应几乎没发生,欲提高N2O的百分含量,应是反应向副反应方向进行4NH3(g)+4O2(g)?2N2O(g)+6H2O (g),改变主反应反应历程,可以选择合适的催化剂是副反应发生,
故答案为:采用合适的催化剂;
(3)反应原理是利用电解吸收NO生成氮气,氮元素化合价+2价变化为0价,发生还原反应,在电解池的阴极发生还原反应,则a为外接电源的负极,固体电解质起到传导作用的是O2-,通入NO的电极反应式为2NO+4e-=N2+2O2-,
故答案为:负;2NO+4e-=N2+2O2-.
点评 本题考查了热化学方程式书写、平衡常数的计算、影响化学平衡的因素分析、电解池原理等知识点,注意图象中曲线的变化为趋势,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | BaSO4溶解的量减小 | B. | BaSO4的电离程度减小 | ||
| C. | 溶液的导电能力增大 | D. | c (Ba2+)与c (SO42-)的乘积增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L苯中含有分子的数目为0.5NA | |
| B. | 0.1mol丙烯酸中含有双键的数目为0.1NA | |
| C. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| D. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
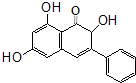 高良姜素是姜科植物高良姜根中的提取物,它能使鼠伤寒沙门氏菌TA98和TA100发生诱变,具有抗病菌作用.下列关于高良姜素的叙述正确的是( )
高良姜素是姜科植物高良姜根中的提取物,它能使鼠伤寒沙门氏菌TA98和TA100发生诱变,具有抗病菌作用.下列关于高良姜素的叙述正确的是( )| A. | 高良姜素的分子式为C15H15O5 | |
| B. | 高良姜素分子中含有3个羟基、8个双键 | |
| C. | 高良姜素能与碳酸钠溶液、溴水、酸性高锰酸钾溶液等反应 | |
| D. | 1mol高良姜素与足量的钠反应生成33.6LH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁与氢碘酸反应:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 向沸水中滴加饱和的氯化铁溶液:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| C. | FeBr2溶液中通入足量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2++4Cl- | |
| D. | 向FeCl2溶液中加入少量K3[Fe(CN)6]溶液:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:1 | B. | 1:1 | C. | 2:1 | D. | 1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 产生了砖红色沉淀,因黑色物质的遮盖而看不见 | |
| B. | 不可能产生砖红色沉淀,因为在加入少量新制备的Cu(OH)2前,没有把水解后的溶液调至碱性 | |
| C. | 蔗糖水解的最终产物不仅有葡萄糖,而且有果糖 | |
| D. | 产生的黑色物质可能是Cu(OH)2受热分解的产物CuO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com