
| 元素 | 相关信息 |
| A | 原子核外L层电子数是K层的2倍 |
| B | 其一种单质被称为地球生物的“保护伞” |
| C | 焰色反应呈黄色 |
| D | 与B同主族的短周期元素 |
| E | 可形成多种氧化物,其中一种为具有磁性的黑色晶体 |

 .
.分析 A元素原子核外L层电子数是K层的2倍,则L层有4个电子,故A为碳元素;B元素的一种单质被称为地球生物的“保护伞”,故B为氧元素;C元素焰色反应呈黄色,故C为Na元素;D是与B同主族的短周期元素,故D为S元素;E元素可形成多种氧化物,其中一种为具有磁性的黑色晶体,故E为Fe元素,据此解答.
解答 解:A元素原子核外L层电子数是K层的2倍,则L层有4个电子,故A为碳元素;B元素的一种单质被称为地球生物的“保护伞”,故B为氧元素;C元素焰色反应呈黄色,故C为Na元素;D是与B同主族的短周期元素,故D为S元素;E元素可形成多种氧化物,其中一种为具有磁性的黑色晶体,故E为Fe元素.
(1)E为Fe元素,处于周期表中第四周期第Ⅷ族,D为硫元素,原子结构示意图为 ,
,
故答案为:第四周期第Ⅷ族; ;
;
(2)B、C、D的简单离子分别为O2-、Na+、S2-,电子层排布相同,核电荷数越大离子半径越小,最外层电子数相同,电子层越多离子半径越大,故离子半径由大到小的顺序为:S2->O2->Na+,
由于非金属性O>S,故气态氢化物中稳定性H2O>H2S,
故答案为:S2->O2->Na+;H2O;
(3)B、C的单质按物质的量比1:2形成的化合物为Na2O2,含有离子键、共价键,电子式为 ,
,
故答案为:离子键、共价键; ;
;
(4)E的黑色磁性晶体为Fe3O4,发生铝热反应的化学方程式是:3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3,
故答案为:3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3.
点评 本题考查结构性质位置关系、核外电子排布规律、微粒半径比较、化学键、电子式等,难度不大,旨在考查学生对基础知识的全面掌握.


科目:高中化学 来源: 题型:选择题
| A. | 第ⅠA族元素都是典型的金属元素 | |
| B. | 第三周期的元素的原子核外都有三个电子层 | |
| C. | F、Cl、O、N四种元素都是第ⅦA族的元素 | |
| D. | 原子的最外层有两个电子的元素都在第ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
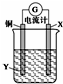
| A. | X可以是银或石墨 | B. | 电子从铜电极经外电路流向X电极 | ||
| C. | Y是硫酸铜溶液 | D. | X极上的电极反应式为Ag++e-═Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. +(n-1)H2O
+(n-1)H2O
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学性质较活泼的金属为负极 | B. | 在正极上发生氧化反应 | ||
| C. | 在外电路,电子流出的极为正极 | D. | 是由电能转化为化学能的装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 金属锡的冶炼常用焦炭作还原剂:SnO2(s)+2C(s)═Sn(s)+2CO(g),反应过程中能量的变化如图所示.下列有关该反应的△H、△S的说法中正确的是( )
金属锡的冶炼常用焦炭作还原剂:SnO2(s)+2C(s)═Sn(s)+2CO(g),反应过程中能量的变化如图所示.下列有关该反应的△H、△S的说法中正确的是( )| A. | △H<0△S<0 | B. | △H>0△S<0 | C. | △H<0△S>0 | D. | △H>0△S>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 请你利用所学反应原理知识解决下列问题:
请你利用所学反应原理知识解决下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2015年2月15日起,湖南省环保厅按照《环境空气质量标准》(GB3095-2012)发布了全省14市州政府所在地城市空气质量排名,主要污染物包括PM2.5、PM10、O3、CO2、SO2和NO2等6项指标 | |
| B. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 | |
| C. | 明矾水解产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒 | |
| D. | 将实验室的废酸液和废碱液中和后再排放符合“绿色化学”的要求 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com