
| A. | 煤和水煤气均是二次能源 | |
| B. | 煤的干馏为化学变化,煤的液化和气化为物理变化 | |
| C. | 煤中含有苯、甲苯、二甲苯等有机物 | |
| D. | 由水煤气转化为甲醇或乙酸时,原子利用率均达到100% |
分析 A.一级能源是指可以从自然界直接获取的能源,如:水能、风能、太阳能、地热能、核能、化石燃料;由一级能源经过加工转换以后得到的能源,称为二级能源,例如:电能、蒸汽、煤气、汽油、柴油、水煤气、干馏煤气等;
B.有新物质生成的反应为化学变化;
C.煤是有无机物和有机物组成的复杂的混合物,煤中不含有苯、甲苯、二甲苯等有机物;
D.水煤气为CO和H2,CO和H2在一定条件下按照不同的比例反应,可假定反应时的化学计量数之比为m:n,则只要各选项中的化学式能化为形式(CO)m(H2)n,都是正确的.
解答 解:A.煤是一次能源,故A错误;
B.煤的干馏是将煤隔绝空气加强热使煤发生复杂的化学反应的过程,主要得到煤焦油、焦炉气、焦炭、粗氨水,煤的气化是让煤在高温条件下与水蒸气反应生成氢气和一氧化碳;煤的液化是利用煤制取甲醇的反应,故均为化学变化,故B错误;
C.煤是有无机物和有机物组成的复杂的混合物,通过干馏和得到苯、甲苯、二甲苯等有机物,故C错误;
D.水煤气为CO和H2,CO和H2在一定条件下按照不同的比例反应,甲醇(CH4O)可变为(CO)1(H2)2,乙酸(C2H4O2)可变为(CO)2(H2)2,原子利用率均达到100%,故D正确.
故选D.
点评 本题考查煤和石油的综合利用,题目难度不大,注意绿色化学即反应物中的原子利用率达到100%,也就是说反应类型一般是化合反应,唯一的生成物即是产品.


科目:高中化学 来源: 题型:选择题
| A. | KAl(SO4)2•12H2O能水解生成Al(OH)3胶体,可用作净水剂 | |
| B. | SO2有漂白、杀菌性能,可在食品加工中大量使用 | |
| C. | MnO2有较强的氧化性,可作H2O2分解的氧化剂 | |
| D. | Si是半导体材料,可用于制光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 实验目的 | 实验操作 | |
| A | 比较水和乙醇分子中羟基上氢原子的活泼性 | 用质量相等、形状相近的金属钠分别与水和乙醇反应 |
| B | 鉴别乙烷和乙烯 | 分别将气体通入品红溶液 |
| C | 除去苯中混有的少量苯酚 | 加入足量的氢氧化钠溶液,充分振荡后分液 |
| D | 检验淀粉与稀硫酸加热后是否水解 | 加入少量新制的氢氧化铜悬浊液并加热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金一定是由两种或多种金属熔合而成的 | |
| B. | 日常生活中用到的五角硬币属于铜合金 | |
| C. | 铝合金的硬度比铝的大,熔点比铝的高 | |
| D. | 商代的司母戊鼎是由纯铜打造而成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.信息二:氯化铬酰(CrO2Cl2)是铬的一种化合物,常温下该化合物是暗红色液体,熔点为-96.5℃,沸点为117℃,能和丙酮(CH3COCH3)、四氯化碳、CS2等有机溶剂互溶.
信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.信息二:氯化铬酰(CrO2Cl2)是铬的一种化合物,常温下该化合物是暗红色液体,熔点为-96.5℃,沸点为117℃,能和丙酮(CH3COCH3)、四氯化碳、CS2等有机溶剂互溶.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②④ | C. | ①②③ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在水中加入少量NaHCO3固体 | B. | 在水中滴入少量稀硫酸 | ||
| C. | 在水中加入少量氯化铝固体 | D. | 将水加热到100℃,测得pH=6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
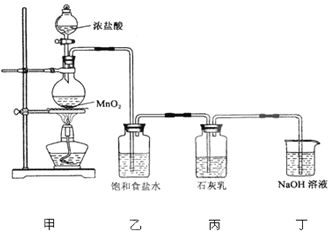
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 锌-空气电池(原理如图)适宜用作城市电动车的动力电源.该电池放电时Zn转化为ZnO.该电池工作时下列说法正确的是( )
锌-空气电池(原理如图)适宜用作城市电动车的动力电源.该电池放电时Zn转化为ZnO.该电池工作时下列说法正确的是( )| A. | 氧气在石墨电极上发生氧化反应 | |
| B. | 该电池的负极反应为Zn+H2O-2e-=ZnO+2H+ | |
| C. | 该电池放电时OH-向石墨电极移动 | |
| D. | 该电池充电时应将Zn电极与电源负极相连 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com