
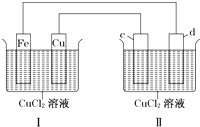
 下列装置可实现电解CuCl2溶液,c、d均为石墨.读图回答下列问题:
下列装置可实现电解CuCl2溶液,c、d均为石墨.读图回答下列问题:| 3.2g |
| 64g/mol |
| 0.1mol |
| 2 |


科目:高中化学 来源: 题型:
| A、向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B、向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大 |
| C、向水中加入少量固体CH3COONa,平衡正向移动,c(H+)降低 |
| D、将水加热,Kw增大,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 石油裂解产品乙烯是一种重要的化工原料,我们已学过用两种方法制得乙烯:在实验室里用乙醇与浓硫酸共热制乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计如图实验图以确认上述混合气体中有C2H4和SO2,回答下列问题:
石油裂解产品乙烯是一种重要的化工原料,我们已学过用两种方法制得乙烯:在实验室里用乙醇与浓硫酸共热制乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计如图实验图以确认上述混合气体中有C2H4和SO2,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓度/mol?L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.050 | 0.025 | 0.025 |
| 30 | 0.050 | 0.025 | 0.025 |
| 40 | 0.036 | 0.032 | 0.010 |
| 50 | 0.036 | 0.032 | 0.010 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知X、Y和Z三种元素的原子序数之和等于48.X的一种1:1型常见气态氢化物分子中既有σ键又有π键.Z是金属元素,Z的单质和化合物有广泛的用途.已知Z的核电荷数小于28,且次外层有2个未成对电子.工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐).M有显著的“压电性能”,应用于超声波的发生装置.经X射线分析,M晶体的最小重复单位为正方体(如右图),顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.
已知X、Y和Z三种元素的原子序数之和等于48.X的一种1:1型常见气态氢化物分子中既有σ键又有π键.Z是金属元素,Z的单质和化合物有广泛的用途.已知Z的核电荷数小于28,且次外层有2个未成对电子.工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐).M有显著的“压电性能”,应用于超声波的发生装置.经X射线分析,M晶体的最小重复单位为正方体(如右图),顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 括号内为杂质 | 除杂试剂 | 操作 | |
| 1 | 乙炔(硫化氢) | ||
| 2 | 溴苯(溴) | ||
| 3 | 甲烷(乙烯) | ||
| 4 | 乙醇(水) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲苯的一氯代物有4种结构,甲苯与过量H2催化加成的最终产物,其一氯代物也有4种结构 |
| B、淀粉不能与银氨溶液发生反应,淀粉水解后的产物也不能与银氨溶液发生反应 |
| C、乙酸与乙醇反应生成乙酸乙酯属于取代反应,乙酸乙酯水解生成乙酸与乙醇也属于取代反应 |
| D、柴油、汽油属于烃类物质,牛油、植物油也属于烃类物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com