
 前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子得到一个电子后3p轨道全充满;D最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,有F+和F2+两种离子.回答下列问题:
前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子得到一个电子后3p轨道全充满;D最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,有F+和F2+两种离子.回答下列问题:分析 前四周期元素A、B、C、D、E、F,原子序数依次增大,A和B同周期,固态的AB2能升华,AB2为CO2,则A为碳元素,B为氧元素;E原子得到一个电子后3p轨道全充满,则E最外层电子数为7,故E为氯元素;C和E原子都有一个未成对电子,C+比E-少一个电子层,则C为钠元素;D的最高化合价和最低化合价代数和为4,D最外层电子数为6,D原子序数大于钠元素小于氯元素,故D为硫元素,其最高价氧化物SO3中S的质量分数为40%,且核内质子数等于中子数,符合题意;F为红色单质,有F+和F2+两种离子,则F为铜元素.
(1)同周期自左而右元素电负性增强;
(2)碳单质金刚石为原子晶体,氧气形成分子晶体,原子晶体熔点高于分子晶体;
(3)四氯化碳是分子晶体,分子中碳原子最外层电子全部成键,成4个C-Cl键,碳原子杂化轨道数为4;
(4)Cu元素原子核外电子数为29,根据核外电子排布规律书写电子排布式;[Cu(NH3)4]SO4•H2O晶体中铜离子与NH3之间形成配位键;
(5)水分子之间存在氢键,沸点高于硫化氢;
(6)根据均摊法计算晶胞中Xn-、C+数目,据此判断阴阳离子之比;以右边前面顶点的Xn-研究,三条棱向上、向前、向右延伸,还有3个距离的C+离子.
解答 解:前四周期元素A、B、C、D、E、F,原子序数依次增大,A和B同周期,固态的AB2能升华,AB2为CO2,则A为碳元素,B为氧元素;E原子得到一个电子后3p轨道全充满,则E最外层电子数为7,故E为氯元素;C和E原子都有一个未成对电子,C+比E-少一个电子层,则C为钠元素;D的最高化合价和最低化合价代数和为4,D最外层电子数为6,D原子序数大于钠元素小于氯元素,故D为硫元素,其最高价氧化物SO3中S的质量分数为40%,且核内质子数等于中子数,符合题意;F为红色单质,有F+和F2+两种离子,则F为铜元素.
(1)D为硫元素,E为氯元素,同周期自左而右,元素电负性增强,所以电负性D<E,
故答案为:<;
(2)A为碳元素,B为氧元素;碳单质金刚石为原子晶体,氧气形成分子晶体,所以熔点A>C,
故答案为:>;
(3)A为碳元素,E为氯元素,AE4为CCl4,碳原子最外层电子全部成键,成4个C-Cl键,碳原子杂化轨道数为4,采取sp3杂化,属于分子晶体,
故答案为:sp3;分子晶体;
(4)F为铜元素,核外电子数为29,F的核外电子排布式为1s22s22p63s23p63d104s1;向F的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出蓝色晶体,该晶体为[Cu(NH3)4]SO4•H2O,晶体中铜离子与NH3之间的化学键为配位键,
故答案为:1s22s22p63s23p63d104s1;配位键;
(5)B为氧元素、D为硫元素,对应氢化物分别为水、硫化氢,水分子间存在氢键,增大分子间作用力,所以氢化物的沸点:B比D高,
故答案为:水分子间存在氢键,增大分子间作用力;
(6)由CnX晶体的最小结构单元可知,该晶体晶胞中Xn-数目为8×$\frac{1}{8}$=1,C+数目为12×$\frac{1}{4}$=3,所以晶体中阳离子和阴离子个数比为3:1;以右边前面顶点的Xn-研究,三条棱向上、向前、向右延伸,还有3个距离的C+离子,所以晶体中每个Xn-被6个等距离的C+离子包围,
故答案为:3:1;6.
点评 本题事实对物质结构的考查,涉及电子排布式、杂化轨道类型、以及晶体结构分析等知识,题目具有一定难度,本题注意晶胞配位数的判断方法及均摊计算法.


科目:高中化学 来源: 题型:选择题
| A. | NaCl晶体溶于水 | B. | 氯原子结合成氯分子 | ||
| C. | 臭氧转化为氧气 | D. | 干冰气化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯与水反应生成乙醇 | B. | 淀粉水解生成葡萄糖 | ||
| C. | 以苯和溴为原料生产溴苯 | D. | 乙烯聚合为聚乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验操作 | 实验现象 | 实验结论 |
| D管生成的是NaNO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
. +H2O$\stackrel{催化剂}{→}$
+H2O$\stackrel{催化剂}{→}$ +HCl、
+HCl、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
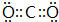 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com