
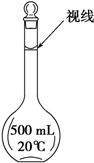
 实验室配制500mL 0.2mol/L的FeSO4溶液,实验操作步骤有:
实验室配制500mL 0.2mol/L的FeSO4溶液,实验操作步骤有:分析 (1)根据配制一定物质的量浓度的溶液的配制步骤进行排序;
(2)根据配制一定物质的量浓度的溶液的配制步骤选择需要仪器;
(3)俯视刻度线导致溶液体积偏小,依据C=$\frac{n}{V}$进行误差分析;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=nV进行误差分析;
(5)任何不当操作导致实验失败且无法补救的都必须重新配制.
解答 解:(1)配制一定物质的量浓度溶液的步骤为:计算、称量、溶解、转移、洗涤、定容、摇匀等,所以操作步骤和正确顺序为:①②④③⑤,
故答案为:①②④③⑤;
(2)配制一定物质的量浓度的溶液的配制步骤:计算、称量、溶解、转移、洗涤、定容、摇匀,用到的仪器:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,
故答案为:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管;
(3)图中同学俯视刻度线,导致溶液体积偏小,依据C=$\frac{n}{V}$溶液浓度偏高;
故答案为:偏高;
(4)没有进行洗涤操作,导致溶质的物质的量偏小,溶液浓度偏低;加蒸馏水时不慎超过了刻度,导致溶液体积偏大,溶液浓度偏低;
故答案为:偏低;偏低;
(5)若实验过程中出现加蒸馏水时不慎超过了刻度,导致溶液失败且无法补救,所以应重新配制;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面,导致溶液失败且无法补救,所以应重新配制;
故答案为:重新配制;重新配制.
点评 本题考查了配制一定物质的量浓度的溶液的方法及误差分析,题目难度不大,试题基础性强,该题的难点在于误差分析,需要明确的是根据c=$\frac{n}{V}$,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都正确 | B. | 只有①② | C. | 只有①②③ | D. | 只有①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,22.4L水所含有的原子数目为3NA | |
| B. | 标准状况下,22.4 L H2中含质子数为2NA | |
| C. | 0.1mol•L-1稀硫酸100mL中含有硫酸根个数为0.1NA | |
| D. | 0.1molOH-含NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 由C与水反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑.
由C与水反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0℃、101kPa条件下,11.2L丁烷中含极性共价键数目为5NA | |
| B. | 含23g钠元素的Na2O和Na2O2混合物中阴离子数目介于0.5NA和NA之间 | |
| C. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$4N2↑+2HNO3+9H2O中氧化产物比还原产物每多14g,转移电子数为15NA | |
| D. | 用惰性电极电解饱和碳酸钠溶液时,电路上通过2mol电子时产生气体分子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com