
| A.Al(OH)3 | B.PbCl2 | C.Ag3PO4 | D.ZnCO3 |
科目:高中化学 来源:不详 题型:填空题
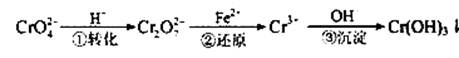
 Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O Cr3+(aq)+3OH—(aq)
Cr3+(aq)+3OH—(aq)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
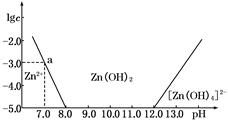
| c(HCl) | | | | | | | |
| (mol/L) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| 103c(PbCl2) | | | | | | | |
| (mol/L) | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
| A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大 |
| B.PbCl2固体在0.50 mol/L盐酸中的溶解度小于在纯水中的溶解度 |
| C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子) |
| D.PbCl2固体可溶于饱和食盐水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等 |
| B.在此饱和溶液中加水,KSP(AgCl)增大 |
| C.在此饱和溶液中加浓的Na2S溶液,生成黑色沉淀 |
| D.向AgCl饱和溶液中加入NaCl固体,c(Ag+)不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 mAn+(aq)+nBm-(aq) [An+]m·[Bm-]n=Ksp
mAn+(aq)+nBm-(aq) [An+]m·[Bm-]n=Ksp查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
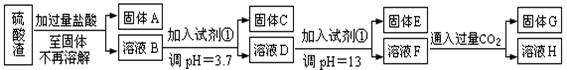
| A.氢氧化钠 | B.氧化铝 | C.氨水 | D.水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 .盐碱地(含较多NaCl、Na2CO3)不利于作物生成,通过施加适量石膏(CaSO4)可以降低土壤的碱性。
.盐碱地(含较多NaCl、Na2CO3)不利于作物生成,通过施加适量石膏(CaSO4)可以降低土壤的碱性。 加入石膏降低土壤碱性的反应原理 ;
加入石膏降低土壤碱性的反应原理 ; 请分析水垢中的CaSO4转化为CaCO3的原理 ;
请分析水垢中的CaSO4转化为CaCO3的原理 ;查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a>b>c>d | B.d>b>c>a | C.a>d>b>c | D.c>b>d>a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com