
| A. | ②⑤⑧⑨⑩ | B. | ②④⑥⑦ | C. | ②⑤⑦⑧⑩ | D. | ①②③④⑤⑥⑦⑧ |
分析 既能与酸性KMnO4溶液反应,又能与溴水反应,则有机物中含碳碳双键、碳碳三键、-CHO等,或为具有还原性的物质,以此来解答.
解答 解:①苯与高锰酸钾、溴水均不反应,故不选;
②苯乙烯中含碳碳双键,与溴水、高锰酸钾均反应,故选;
③甲苯与溴水不反应,故不选;
④乙醇与溴水不反应,故不选;
⑤己烯中含碳碳双键,与溴水、高锰酸钾均反应,故选;
⑥己烷与高锰酸钾、溴水均不反应,故不选;
⑦亚硫酸具有还原性,与溴水、高锰酸钾均反应,故选;
⑧聚丁二烯中含碳碳双键,与溴水、高锰酸钾均反应,故选;
⑨聚乙烯与高锰酸钾、溴水均不反应,故不选;
⑩聚乙炔中含碳碳双键,与溴水、高锰酸钾均反应,故选;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、氧化还原反应为解答的关键,侧重分析与应用能力的考查,注意烯烃、醇等常见有机物的性质,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
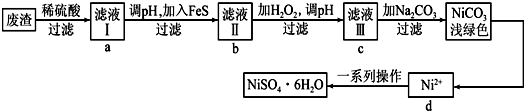
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 反应物 | 加入物质 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 9mL 5% H2O2溶液 | 1mL 水 |
| ④ | 9mL 5% H2O2溶液 | 1mL 0.1mol•L-1 HCl溶液 |
| ⑤ | 9mL 5% H2O2溶液 | 1mL 0.1mol•L-1 NaOH溶液 |

| 物理量 实验序号 | V[30% H2O2]/mL | … | |
| 1 | a | … | |
| 2 | a | … |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中一定含有金属阳离子 | |
| B. | 含有共价键的化合物一定是共价化合物 | |
| C. | 在酸碱盐中,碱与盐一定属于离子化合物 | |
| D. | 离子化合物中一定存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
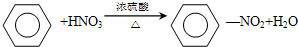 ,属于取代反应;
,属于取代反应; ,属于加成反应;
,属于加成反应; +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ +HBr,属于取代反应;
+HBr,属于取代反应;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
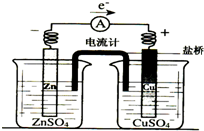
| A. | 铜片上有气泡逸出 | |
| B. | 取出盐桥后,电流计依然发生偏转 | |
| C. | 反应中,盐桥中的K+会移向CuSO4溶液 | |
| D. | 铜片上发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ②③ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
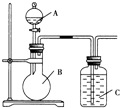 某甲同学设计如图装置,比较非金属元素的非金属性强弱.请按要求回答下列问题:
某甲同学设计如图装置,比较非金属元素的非金属性强弱.请按要求回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com