
| A. | 1molO2在任何情况下都是32g | B. | 摩尔是一个基本物理量 | ||
| C. | H2SO4的摩尔质量是98g | D. | 1摩尔氢的质量是2g |
分析 A.O2的摩尔质量为32g/mol;
B.摩尔是物质的量的单位;
C.H2SO4的摩尔质量是98g/mol;
D.使用物质的量应指明具体的物质或微粒.
解答 解:A.O2的摩尔质量为32g/mol,1molO2在任何情况下都是32g,故A正确;
B.物质的量是国际单位制中七个基本物理量之一,摩尔是物质的量的单位,故C错误;
C.1mol H2SO4的质量是98g,H2SO4的摩尔质量是98g/mol,故C错误
D.1摩尔氢指代明确,不能确定是氢气还是氢原子,使用物质的量应指明具体的物质或微粒,故D错误,
故选:A.
点评 本题考查物质的量、摩尔质量,比较基础,注意使用物质的量应指明具体的物质或微粒.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 碱性氧化物均为金属氧化物 | |
| B. | 一种元素可能有多种氧化物,但是同种化合价只对应一种氧化物 | |
| C. | 酸根离子中不可能含有金属元素 | |
| D. | 还原产物只有还原性,氧化产物只有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水溶解后过滤分离 | B. | 用稀盐酸溶解过滤分离 | ||
| C. | 用稀硫酸溶解过滤分离 | D. | 用酒精灯加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | M层上有2对成对电子 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
| J | J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
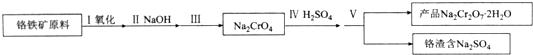
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V=4.48 L | B. | V=5.6 L | C. | 4.48 L<V<5.6 L | D. | V<4.48 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
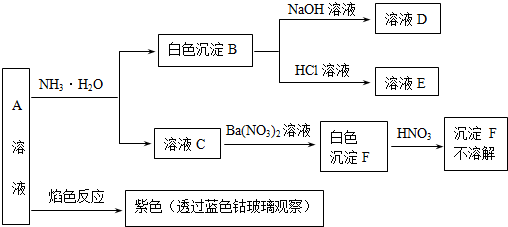
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的氧化剂是H2C2O4 | B. | 1molMnO4-在反应中失去5mol电子 | ||
| C. | 从反应中看出草酸性质很不稳定 | D. | 配平该反应后,H+的计量数是6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同温度下的溶解度:Na2CO3>NaHCO3 | |
| B. | 热稳定性:Na2CO3>NaHCO3>H2CO3 | |
| C. | 表示Na2CO3和NaHCO3分别与Ba(OH)2溶液反应的离子方程式相同 | |
| D. | 等质量的Na2CO3和NaHCO3分别与等浓度的HCl溶液完全反应,后者消耗的盐酸少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com