
分析 (1)锌和盐酸反应生成氯化锌和氢气;
(2)依据化学方程式定量关系计算得到;
(3)依据化学方程式计算生成的锌离子物质的量,剩余氢离子物质的量,c=$\frac{n}{V}$计算浓度.
解答 解:(1)锌和盐酸反应生成氯化锌和氢气,反应的离子方程式为:Zn+2H+=Zn2++H2↑,
答:离子反应为Zn+2H+=Zn2++H2↑;
(2)将0.65g锌物质的量=$\frac{0.65g}{65g/mol}$=0.01mol,50mL 1mol•L的盐酸中溶质物质的量=0.050L×1mol•L-1=0.05mol;
Zn+2HCl=ZnCl2+H2↑
0.01mol 0.02mol
可知氯化氢过量,依据反应的锌物质的量计算生成氢气物质的量为0.01mol,标准状况下气体体积=0.01mol×22.4L/mol=0.224L,
答:体积为0.224L;
(3)由化学方程式可知生成的锌离子物质的量为0.01mol,剩余氢离子物质的量=0.05mol-0.02mol=0.03mol,若反应结束后,溶液的体积仍为50mL依据c=$\frac{n}{V}$计算浓度,锌离子浓度=$\frac{0.01mol}{0.05L}$=0.2mol/L,氢离子浓度=$\frac{0.03mol}{0.05L}$=0.6mol/L,
答:溶液中的Zn2+的物质的量浓度为0.2mol/L,H+物质的量浓度为0.6mol/L.
点评 本题考查了离子方程式书写,离子浓度计算和化学方程式计算分析,主要是过量计算的分析判断,掌握基础是关键,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | ①③④⑦ | B. | ②③⑤⑦ | C. | ①④⑥⑦ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.1gCl2与足量NaOH溶液反应转移0.2×6.02×1023个电子 | |
| B. | 1mol羟基中含有的电子数目为9×6.02×1023个 | |
| C. | 标准状况下,2.24L辛烷含有0.8×6.02×1023个碳原子 | |
| D. | 1L 0.50mol/L Na2CO3溶液中含有1.5×6.02×1023个离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol H2O的质量为36g/mol | |
| B. | NH3的摩尔质量为17g | |
| C. | 3.01×1023个SO2分子的质量为32g | |
| D. | 标准状况下,3 mol任何物质体积均为67.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2+3H2=2NH3属于自然固氮 | |
| B. | 固氮属于氧化还原反应 | |
| C. | 俗语“雷雨发庄稼”毫无科学道理 | |
| D. | 氨气溶于水得到的溶液能导电,所以NH3是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
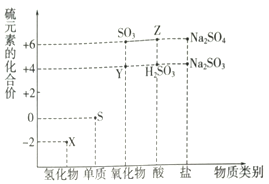 利用元素的化合价推测物质的性质是化学研究的重要手段.
利用元素的化合价推测物质的性质是化学研究的重要手段.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com