
【题目】在恒温恒容的容器中,发生反应:H2(g)+CO(g)![]() C(s)+H2O(g),初始时加入平均相对分子质量为15的H2、CO混合气,一段时间后测得气体的平均相对分子质量为16,下列说法正确的是
C(s)+H2O(g),初始时加入平均相对分子质量为15的H2、CO混合气,一段时间后测得气体的平均相对分子质量为16,下列说法正确的是
A. 当气体的平均相对分子质量为16时该反应达平衡B. 此时CO的转化率为40%
C. 反应前后气体的密度之比为5∶4D. 反应前后气体的压强之比为2∶1
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂。制备硝基苯的过程如下:
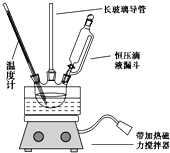
①组装如图反应装置。配制混酸,取100mL烧杯,用20mL浓硫酸与18 mL浓硝酸配制混酸,加入漏斗中,把18 mL 苯加入三颈烧瓶中。
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀。
③在50~60℃下发生反应,直至反应结束。
④除去混酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品。
已知:i.![]() +HNO3(浓)
+HNO3(浓) +H2O
+H2O
![]() +HNO3(浓)
+HNO3(浓)
 +H2O
+H2O
ii可能用到的有关数据列表如下:

(1)配制混酸应在烧杯中先加入___________。
(2)恒压滴液漏斗的优点是_____________。
(3)实验装置中长玻璃管可用_______代替(填仪器名称).
(4)反应结束后,分离混酸和产品的操作方法为_________。
(5)为了得到更纯净的硝基苯,还需先向液体中加入___(填化学式)除去水,然后采取的最佳实验操作是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”的主要内容之一是指从技术、经济上设计可行的化学反应,使原子充分利用,不产生污染物.下列化学反应符合“绿色化学”理念的是
A. 制CuSO4:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
B. 制Cu(NO3)2:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
C. 制CuSO4:2Cu+O2![]() 2CuO; Cu+H2SO4(稀)═CuSO4+H2O
2CuO; Cu+H2SO4(稀)═CuSO4+H2O
D. 制Cu(NO3)2:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸铅[(CH3COO)2Pb]因有甜味而被称为“铅糖”,它有毒但能入药。已知(CH3COO)2Pb可溶于水,硝酸铅与醋酸钠溶液反应的离子方程式为Pb2++2CH3COO-![]() (CH3COO)2Pb。下列有关说法中不正确的是
(CH3COO)2Pb。下列有关说法中不正确的是
A. 0.1 mol·L-1的“铅糖”溶液中c(Pb2+)<0.1 mol·L-1
B. “铅糖”是强电解质
C. “铅糖”是共价化合物
D. “铅糖”的溶液可能导电性很弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A与B在容积为1 L的密闭容器中发生反应:aA(s)+bB(g)![]() cC(g)+dD(g),t1、t2时刻分别测得部分数据如下表。下列说法正确的是
cC(g)+dD(g),t1、t2时刻分别测得部分数据如下表。下列说法正确的是
n(B)/mol | n(C)/mol | n(D)/mol | 反应时间/min |
0.12 | 0.06 | 0.10 | t1 |
0.06 | 0.12 | 0.20 | t2 |
A. 0~t1时间段内,平均反应速率v(B)=0.04/t1 mol·(L·min)-1
B. 若起始时n(D)=0,则t2时刻v(D)=0.20/t2 mol·(L·min)-1
C. 升高温度,v(B)、v(C)、v(D)均增大
D. b∶d=6∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了A~R 10种元素在周期表中的位置(填元素符号):
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | E | J | F | |||||
3 | A | C | D | G | R | |||
4 | B | H |
i. 请填空:
(1)这10种元素中,化学性质最不活泼的是____(填元素符号)。
(2)D元素最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是____。
(3)A、B、C三种元素按原子半径由大到小的顺序排列为____(填元素符号)。
(4)EF2的电子式为____,F元素的最简单氢化物在常温下跟B发生反应的化学方程式是____。
(5)G元素和H元素两者核电荷数之差是____。
ii. 元素J的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NO2反应进行了探究。回答下列问题:
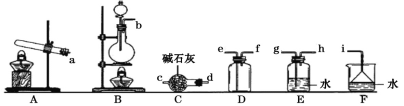
①只用固体药品制备氨气的发生装置可以选择上图中的____,反应的化学方程式为____。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→____(按气流方向,用小写字母表示)。
③将上述收集到的NH3充入无色透明烧瓶中,并加入少量催化剂,然后充入NO2。常温下反应一段时间后的实验现象为____,反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.O2-、F-、Na+、Mg2+半径依次减小
B.O2和O3是氧元素的同素异形体
C.同一元素的不同核素化学性质几乎完全相同
D.同主族元素含氧酸的酸性随核电荷数的增加而减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
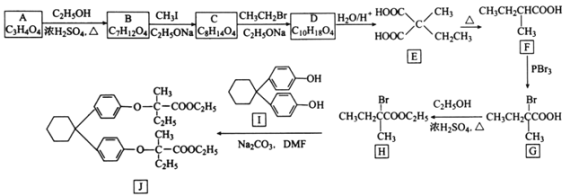
【题目】[化学——选修5:有机化学基础]化合物J是制备降血脂药贝利贝特的中间体,制备J的一种合成路线设计如下:
回答下列问题:
(1)A的化学名称是________________。
(2)G生成H的反应类型是________________;J的分子式为________________。
(3)C的结构简式为________________________。
(4)化合物I可由芳香化合物C6H6O和环状化合物C6H10O在醋酸和盐酸催化下制备得到,该反应的化学方程式为________________________________________。
(5)R与E互为同分异构体且与E具有相同的官能团种类和数目,则R的结构有________种。其中对应的核磁共振氢谱图中有四组峰,且峰面积比为4:3:2:1的结构简式为________。
(6)苯氧乙酸乙酯(![]() )是一种农药,设计由苯酚和乙醇为起始原料制备苯氧乙酸乙酯的合成路线:________________(无机试剂任选)。
)是一种农药,设计由苯酚和乙醇为起始原料制备苯氧乙酸乙酯的合成路线:________________(无机试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com