
分析 (1)工业上常用碳在高温下与二氧化硅反应制取粗硅;
(2)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;
(3)铝和铁的氧化物高温反应生成熔融铁和氧化铝;
(4)硫酸铝与氨水反应生成氢氧化铝沉淀和硫酸铵;
(5)氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水.
解答 解:(1)碳在高温下与二氧化硅反应生成硅与一氧化碳,SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(2)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,化学方程式:2Al+2H2O+2NaOH═2NaAlO2+3H2↑;
故答案为:2Al+2H2O+2NaOH═2NaAlO2+3H2↑;
(3)铝和铁的氧化物高温反应生成熔融铁和氧化铝,化学方程式:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
(4)硫酸铝与氨水反应生成氢氧化铝沉淀和硫酸铵,离子方程式:Al3++3NH3•H2O═Al(OH)3↓+3NH4+;
故答案为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+;
(5)氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,离子方程式:Al2O3+2NaOH═2NaAlO2+H2O,
故答案为:Al2O3+2OH-═2AlO2-+H2O;
点评 本题考查了化学方程式、离子方程式的书写,明确反应实质是解题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
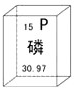
| A. | 磷元素为非金属元素 | B. | 磷原子核外有15个电子 | ||
| C. | 磷的原子序数为15 | D. | 相对原子质量为30.97g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
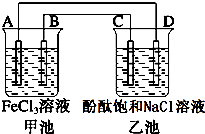 如图所示,甲池中电池反应式为2Fe3++Cu═2Fe2++Cu2+,反应过程中A电极质量逐渐减小,C、D为石墨电极,乙池中为200mL滴加酚酞的饱和NaCl溶液.回答下列问题:
如图所示,甲池中电池反应式为2Fe3++Cu═2Fe2++Cu2+,反应过程中A电极质量逐渐减小,C、D为石墨电极,乙池中为200mL滴加酚酞的饱和NaCl溶液.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C1:C2=1:3 | B. | 平衡时,X和Z的生成速率之比为1:2 | ||
| C. | X、Y的转化率不相等 | D. | C1的取值范围为0<C1<0.14mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
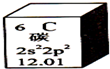 元素周期表是学习化学的重要工具.下图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )
元素周期表是学习化学的重要工具.下图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )| A. | 该元素的三种核素质子数均为6 | B. | 该元素原子最外层有4个电子 | ||
| C. | 该元素的相对原子质量为12.01 | D. | 该元素的原子核外有三个电子层 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
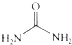 的熔、沸点比醋酸
的熔、沸点比醋酸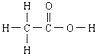 的高.
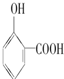
的高.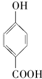 >
>
| A. | ①②③④⑤⑥ | B. | ①②③④⑤ | C. | ①②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a+3b | B. | $\frac{a}{2}$+3b | C. | $\frac{a}{2}$+3b+$\frac{7w}{2}$ | D. | $\frac{a}{2}$+3b-$\frac{7w}{2}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com