
含有6.02×1023个O原子的H3PO4的物质的量是( )
A.1 mol B.0.5 mot C.0.25 mol D.0.125 mol
科目:高中化学 来源: 题型:选择题
| A. | m=8.7 g | |
| B. | 反应过程中转移电子总数为0.1 NA | |
| C. | 反应过程中起氧化性作用的n(HCl)=0.2mol | |
| D. | 滤液中盐酸的浓度为$\frac{2}{3}$ mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4 | B. | FeSO4•7H2O | C. | KAl(SO4)2•7H2O | D. | Fe2(SO4)3•7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:X>Y>Z | B. | 气态氢化物的稳定性:X>Y>Z | ||
| C. | 原子半径:X<Y<Z | D. | 对应阴离子的还原性:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上10月月考化学试卷(解析版) 题型:选择题
关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;④使用之前要检查是否漏水。这些叙述中正确的是( )
A. ①②③④ B. ②③ C. ①②④ D. ②③④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:实验题
某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从图6中选择称量NaOH固体所需要的仪器是(填字母): 。
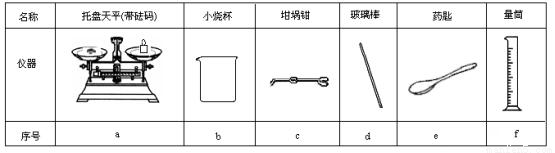
Ⅱ.测定中和热的实验装置如图7所示。

(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式 (中和热数值为57.3 kJ/mol):
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃[ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H= (取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(3)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察右图,然后回答问题。

①图中所示反应是_________(填“吸热”或“放热”)反应,该反应的△H=____________(用含E1、E2的代数式表示)。
②对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是_________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
1913年德国化学家哈伯发明了以低成本制造大量氨的方法,从而大大满足了当时日益增长的人口对粮食的需求。下列是哈伯法的流程图,其中为提高原料转化率而采取的措施是
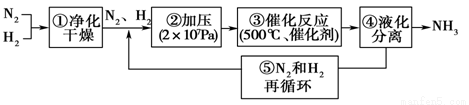
A.①②③ B.②④⑤ C.①③⑤ D.②③④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:填空题
(1)①0.01mol/LNaOH 溶液的pH= 。
溶液的pH= 。
②100mL 0.1mol/L H2SO4溶液与100mL 0.4mol/L的KOH溶液混合后,pH= 。
(2)①已知一溶液有4种离子:X+、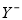 、H+、OH-下列分析结果肯定错误的是( )。
、H+、OH-下列分析结果肯定错误的是( )。
A.CY->CX+>CH+>COH-  B.CX+>CY->COH->CH+
B.CX+>CY->COH->CH+
C.CH+>CY->CX+>COH- D.COH->CX+>CH+>CY-
②把0.02mol·L-1CH3COOH溶液和0.01mol·L-1NaOH溶液以等体积混合,则混合液中粒子浓度关系正确的是(  )
)
A.C(CH3COO-)<C(Na+)
B.C(CH3COOH)>C(CH3COO-)
C.2C(H+)=C(CH3COO-)-C(CH3COOH)
D.C(CH3COOH)+C(CH3COO-)=0.01mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com