
| 酸 | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
| A. | 在冰醋酸中,高氯酸的酸性最强 | |
| B. | 水对于这四种酸的强弱没有区分能力,但醋酸可以区分这四种酸的强弱 | |
| C. | 在冰醋酸中1mol/L的高氯酸的电离度约为0.4% | |
| D. | 在冰醋酸中硫酸的电离方程式为:H2SO4═2H++SO42- |
分析 A.在冰醋酸中,酸的电离平衡常数越大,则其电离程度越大,酸性越强;
B.在溶剂中完全电离的电解质不能区分,不完全电离的电解质能区分;
C.先根据电离平衡常数计算氢离子浓度,氢离子浓度等于电离的高氯酸浓度,再根据电离度公式计算电离度;
D.不完全电离的酸存在电离平衡,电离方程式应用可逆号.
解答 解:A.在醋酸中,四种酸中高氯酸的电离平衡常数最大,所以高氯酸的酸性最强,故A正确;
B.这四种酸在水中都完全电离,在冰醋酸中电离程度不同,所以水对于这四种酸的强弱没有区分能力,但醋酸可以区分这四种酸的强弱,故B正确;
C.在冰醋酸中高氯酸电离出的c(H+)=$\sqrt{1.6×1{0}^{-5}×1}$mol/L=4×10-3mol/L,氢离子浓度等于电离的高氯酸浓度,所以高氯酸的电离程度=$\frac{4×1{0}^{-3}mol/L}{1mol/L}$×100%=0.4%,故C正确;
D.在冰醋酸中,硫酸不完全电离,所以硫酸的电离方程式中应该用可逆号,且分步电离,主要以第一步为主,正确的电离方程式为:H2SO4?H++HSO4-,故D错误;
故选D.
点评 本题考查了电解质的电离,题目难度中等,明确电离平衡常数与酸的强弱之间的关系,根据酸在水溶液里或冰醋酸中电离程度确定电解质强弱与溶剂的关系,注意该溶液的溶剂是冰醋酸不是水.


科目:高中化学 来源: 题型:填空题
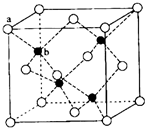 E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于P区的同一周期的元素,M的价层电子排布为nsnnp2n,E与M原子核外的未成对电子数相等;QM2与GM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于P区的同一周期的元素,M的价层电子排布为nsnnp2n,E与M原子核外的未成对电子数相等;QM2与GM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题: .E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.
.E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铝陶瓷和光导纤维都是无机非金属材料 | |
| B. | 硫、氮、碳的氧化物是形成酸雨的主要物质 | |
| C. | 使用氢能源替代化石燃料可减少CO2排放 | |
| D. | 利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
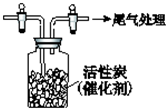 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查阅资料:SO2Cl2常温下为无色液体,极易水解,遇潮湿空气会产生白雾.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查阅资料:SO2Cl2常温下为无色液体,极易水解,遇潮湿空气会产生白雾.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl→H2SO4→H2S→NaOH→CO2 | B. | NaCl→Na2SO4→NaOH→H2S→CO2 | ||
| C. | Na2S→Na2SO4→NaCl→NaOH→CO2 | D. | Na2SO4→HCl→H2S→NaOH→CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com