
”¾ĢāÄæ”æÄ³Ń§Ļ°Š”×éÓĆČēĶ¼ĖłŹ¾×°ÖĆ²ā¶ØĀĮĆ¾ŗĻ½šÖŠĀĮµÄÖŹĮæ·ÖŹżŗĶĀĮµÄĻą¶ŌŌ×ÓÖŹĮ攣
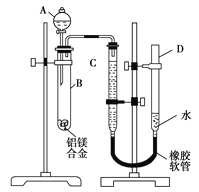
£Ø1£©AÖŠŹŌ¼ĮĪŖ________”£
£Ø2£©ŹµŃéĒ°£¬ĻČ½«ĀĮĆ¾ŗĻ½šŌŚĻ”ĖįÖŠ½žÅŻĘ¬æĢ£¬ĘäÄæµÄŹĒ____________________”£
£Ø3£©¼ģ²éĘųĆÜŠŌ£¬½«Ņ©Ę·ŗĶĖ®×°Čėø÷ŅĒĘ÷ÖŠ£¬Į¬½ÓŗĆ×°ÖĆŗ󣬊č½ųŠŠµÄ²Ł×÷»¹ÓŠ£ŗ¢Ł¼ĒĀ¼CµÄŅŗĆęĪ»ÖĆ£»¢Ś½«BÖŠŹ£Óą¹ĢĢå¹żĀĖ£¬Ļ“µÓ£¬øÉŌļ£¬³ĘÖŲ£»¢Ū“żBÖŠ²»ŌŁÓŠĘųĢå²śÉś²¢»Öø“ÖĮŹŅĪĀŗ󣬼ĒĀ¼CµÄŅŗĆęĪ»ÖĆ£»¢ÜÓÉAĻņBÖŠµĪ¼Ó×ćĮæŹŌ¼Į”£ÉĻŹö²Ł×÷µÄĖ³ŠņŹĒ________(ĢīŠņŗÅ)£»¼ĒĀ¼CµÄŅŗĆęĪ»ÖĆŹ±£¬³żĘ½ŹÓĶā£¬»¹Ó¦________”£
£Ø4£©BÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ__________________________”£
£Ø5£©ČōŹµŃéÓĆĀĮĆ¾ŗĻ½šµÄÖŹĮæĪŖa g£¬²āµĆĒāĘųĢå»żĪŖb mL(ŅŃ»»ĖćĪŖ±ź×¼×“æö)£¬BÖŠŹ£Óą¹ĢĢåµÄÖŹĮæĪŖc g£¬ŌņĀĮµÄĻą¶ŌŌ×ÓÖŹĮæĪŖ________”£
£Ø6£©ŹµŃé¹ż³ĢÖŠ£¬ČōĪ“Ļ“µÓ¹żĀĖĖłµĆµÄ²»ČÜĪļ£¬Ōņ²āµĆĀĮµÄÖŹĮæ·ÖŹż½«________(Ģī”°Ę«“ó”±”°Ę«Š””±»ņ”°²»ŹÜÓ°Ļģ”±)”£
”¾“š°ø”æ NaOHČÜŅŗ ³żČ„ĀĮĆ¾ŗĻ½š±ķĆęµÄŃõ»ÆĤ ¢Ł¢Ü¢Ū¢Ś Ź¹DŗĶCµÄŅŗĆęĻąĘ½ 2Al£«2NaOH£«2H2O=2NaAlO2£«3H2”ü ![]() Ę«Š”
Ę«Š”
”¾½āĪö”æŹŌĢā·ÖĪö£ŗ£Ø1£©ÓÉÓŚBÖŠÓŠ¹ĢĢåŹ£Óą£¬ÕāĖµĆ÷¼ÓČȵďŌ¼Į²»ŹĒĖį£¬¶ųĒāŃõ»ÆÄų£¬Ć¾ÓėĒāŃõ»ÆÄĘ²»·“Ó¦£¬ĀĮÓėĒāŃõ»ÆÄĘČÜŅŗ·“Ӧɜ³ÉĘ«ĀĮĖįÄĘŗĶĒāĘų”£
£Ø2£©ÓÉÓŚĆ¾ĀĮ¾łŹĒ»īĘĆµÄ½šŹō£¬ŌŚĘä±ķĆęÓŠŃõ»ÆĤ£¬ŌņŹµŃéĒ°£¬ĻČ½«ĀĮĆ¾ŗĻ½šŌŚĻ”ĖįÖŠ½žÅŻĘ¬æĢ£¬ĘäÄæµÄŹĒ³żČ„ĀĮĆ¾ŗĻ½š±ķĆęµÄŃõ»ÆĤ”£
£Ø3£©ŹµŃéĒ°Ź×ĻČ¼ĒĀ¼CÖŠŅŗĆęĪ»ÖĆ£¬Č»ŗó¼ÓČėĒāŃõ»ÆÄĘČÜŅŗ£¬µ±²»ŌŁÓŠĘųĢå²śÉśŹ±ŌŁ¼ĒĻĀŅŗĆęĪ»ÖĆ£¬×īŗó½«BÖŠŹ£Óą¹ĢĢå¹żĀĖ”¢Ļ“µÓ”¢øÉŌļ£¬³ĘÖŲ£¬ĖłŅŌÉĻŹö²Ł×÷µÄĖ³ŠņŹĒ¢Ł¢Ü¢Ū¢Ś”£ÓÉÓŚĘųĢåµÄĢå»żŹÜŃ¹ĒæµÄÓ°Ļģ£¬ĖłŅŌŌŁ¼ĒĀ¼ŅŗĆꏱ»¹ŠčŅŖŹ¹DŗĶCµÄŅŗĆęĻąĘ½”£
£Ø3£©ĒāŃõ»ÆÄĘČÜŅŗÓėĀĮ·“Ó¦£¬Ć¾²»·“Ó¦£¬ŌņBÖŠ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ2Al+2NaOH+2H2O£½2NaAlO2+3H2”ü”£
£Ø4£©ĒāĘųµÄĪļÖŹµÄĮæŹĒ![]() £¬Ōņøł¾Ż·½³ĢŹ½æÉÖŖŠčŅŖ½šŹōĀĮµÄĪļÖŹµÄĮæŹĒ
£¬Ōņøł¾Ż·½³ĢŹ½æÉÖŖŠčŅŖ½šŹōĀĮµÄĪļÖŹµÄĮæŹĒ![]() ”£ŗĻ½šÖŠĀĮµÄÖŹĮæŹĒ£Øa”Ŗc£©g£¬ŌņĀĮµÄĻą¶ŌŌ×ÓÖŹĮæŹĒ
”£ŗĻ½šÖŠĀĮµÄÖŹĮæŹĒ£Øa”Ŗc£©g£¬ŌņĀĮµÄĻą¶ŌŌ×ÓÖŹĮæŹĒ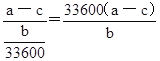 ”£
ӣ
£Ø5£©ŹµŃé¹ż³ĢÖŠ£¬ČōĪ“Ļ“µÓ¹żĀĖĖłµĆµÄ²»ČÜĪļ£¬ŌņŹ£Óą¹ĢĢåÖŹĮæĘ«“󣬼“cĘ«“ó£¬ĖłŅŌ²āµĆĀĮµÄÖŹĮæ·ÖŹż½«Ę«Š””£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄÜÓĆĄ“Ēų±šNH4Cl”¢NaCl”¢Na2CO3ČżÖÖĪļÖŹµÄŹŌ¼Į(±ŲŅŖŹ±æÉŅŌ¼ÓČČ)ŹĒ£Ø £©
A. AgNO3ČÜŅŗ B. Ļ”ĮņĖį C. Ļ”ŃĪĖį D. Ba(OH)2ČÜŅŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ½Ģ²ÄÖŠÓĆĖįŠŌKMnO4ČÜŅŗŗĶH2C2O4£Ø²ŻĖį£©·“Ӧъ¾æÓ°Ļģ·“Ó¦ĖŁĀŹµÄŅņĖŲ£¬Ąė×Ó·½³ĢŹ½ĪŖ£ŗ2MnO4©+5H2C2O4+6H+=2Mn2++10CO2”ü+8H2O£®Ņ»ŹµŃ銔×éÓūĶعż²ā¶Øµ„Ī»Ź±¼äÄŚÉś³ÉCO2µÄĖŁĀŹ£¬Ģ½¾æijÖÖÓ°Ļģ»Æѧ·“Ó¦ĖŁĀŹµÄŅņĖŲ£¬Éč¼ĘŹµŃé·½°øČēĶ¼Ņ»ŗĶ±ķ£ŗ 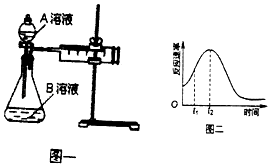
ŹµŃéŠņŗÅ | AČÜŅŗ | BČÜŅŗ |
¢Ł | 20 mL 0.1 molL©1H2C2O4ČÜŅŗ | 30 mL 0.01 molL©1kMnO4ČÜŅŗ |
¢Ś | 20 mL 0.2 molL©1 | 30 mL 0.01 molL©1KMnO4ČÜŅŗ |
£Ø1£©ÓƵēĄė·½³ĢŹ½±ķŹ¾²ŻĖįČÜŅŗĻŌĖįŠŌµÄŌŅņ
£Ø2£©øĆŹµŃéĢ½¾æµÄŹĒŅņĖŲ¶Ō»Æѧ·“Ó¦ĖŁĀŹµÄÓ°Ļģ£®ĻąĶ¬Ź±¼äÄŚÕėĶ²ÖŠĖłµĆCO2µÄĢå»ż“󊔹ŲĻµŹĒ¢Ł¢Ś£ØĢī”°£¾”±”°£¼”±”°=”±£©
£Ø3£©ČōŹµŃé¢ŁŌŚ2minÄ©ŹÕ¼ÆĮĖ896mL CO2£Ø±ź×¼×“æöĻĀ£©£¬ŌņÓĆMnO4©±ķŹ¾øĆŹ±¼äÄŚµÄ»Æѧ·“Ó¦ĖŁĀŹĪŖv £ØMnO4©£©= £®
£Ø4£©³żĶعż²ā¶ØŅ»¶ØŹ±¼äÄŚCO2µÄĢå»żĄ“±Č½Ļ·“Ó¦ĖŁĀŹ£¬±¾ŹµŃ黹æÉĶعż²ā¶ØĄ“±Č½Ļ»Æѧ·“Ó¦ĖŁĀŹ£®
£Ø5£©øĆŹµŃ銔×éĶ¬Ń§·¢ĻÖ·“Ó¦ĖŁĀŹČēĶ¼¶žĖłŹ¾£¬ĘäÖŠt1”«t2Ź±¼äÄŚĖŁĀŹ±äæģµÄÖ÷ŅŖŌŅņæÉÄÜŹĒ£ŗ¢ŁøĆ·“Ó¦·ÅČČ”¢¢Ś £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æøł¾ŻĖłŃ§ÖŖŹ¶ĢīŠ“ĻĀĮŠæÕ°×£®
£Ø1£©ÓŠ»śĪļ ![]() µÄĻµĶ³Ćū³ĘŹĒ £¬ ½«ĘäŌŚ“߻ƼĮ“ęŌŚĻĀĶźČ«Ēā»Æ£¬ĖłµĆĶéĢžµÄĻµĶ³Ćū³ĘŹĒ £® øĆĶéĢžµÄŅ»ĀČ“śĪļ×ī¶ąÓŠÖÖ£®
µÄĻµĶ³Ćū³ĘŹĒ £¬ ½«ĘäŌŚ“߻ƼĮ“ęŌŚĻĀĶźČ«Ēā»Æ£¬ĖłµĆĶéĢžµÄĻµĶ³Ćū³ĘŹĒ £® øĆĶéĢžµÄŅ»ĀČ“śĪļ×ī¶ąÓŠÖÖ£®
£Ø2£©2£¬3©¶ž¼×»ł©4©ŅŅ»łŅŃĶé½į¹¹¼ņŹ½ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ
¹¤ŅµÉĻ³£ĄūÓĆŗ¬Įņ·ĻĖ®Éś²śNa2S2O3 ”¤5H2O£¬Ä³Š”×éĶ¬Ń§ÓĆČēĻĀ×°ÖĆ£ØĀŌČ„²æ·Ö¼Š³ÖŅĒĘ÷£¬ĘųĆÜŠŌŅŃ¼ģŃ飩ģÄāÉś²ś¹ż³Ģ”£ŹµŃé²½ÖčŹĒ£ŗĻČĻņCÖŠÉÕĘæ¼ÓČėNa2SŗĶNa2SO3»ģŗĻČÜŅŗ£¬ŌŁĻņAÖŠÉÕĘæµĪ¼ÓÅØH2SO4£»“żNa2SŗĶNa2SO3ĶźČ«ĻūŗÄŗ󣬹żĀĖCÖŠ»ģŗĻĪļ£¬ĀĖŅŗ¾½į¾§¼“µĆµ½²śĘ·”£
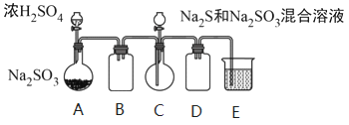
ŅŃÖŖ£ŗi£®ÉÕĘæCÖŠ·¢Éś·“Ó¦ČēĻĀ£ŗ
Na2S(aq)+H2O(l)+SO2(g)===Na2SO3(aq)+H2S(aq) £Øa£©
2H2S(aq)+SO2(g)===3S(s)+2H2O(l)£Øb£©
S(s)+Na2SO3(aq) ![]() Na2S2O3(aq) £Øc£©
Na2S2O3(aq) £Øc£©
ii£®BaS2O3Ņ×ČÜÓŚĖ®”£
£Ø1£©EÖŠµÄŹŌ¼ĮŹĒ__________”£
£Ø2£©ĪŖĢįøß²śĘ·“æ¶Č£¬Ó¦Ź¹ÉÕĘæCÖŠNa2SŗĶNa2SO3Ē”ŗĆĶźČ«·“Ó¦£¬ŌņÉÕĘæCÖŠNa2SŗĶNa2SO3ĪļÖŹµÄĮæÖ®±ČĪŖ__________”£
£Ø3£©ŅŃÖŖ·“Ó¦£Øc£©Ļą¶Ō½ĻĀż£¬ŌņÉÕĘæCÖŠ·“Ó¦“ļµ½ÖÕµćµÄĻÖĻóŹĒ__________”£
£Ø4£©²śĘ·ÖŠ³£ŗ¬ÓŠNa2SO3ŗĶNa2SO4”£øĆŠ”×éÉč¼ĘĮĖŅŌĻĀŹµŃé·½°ø½ųŠŠ¼ģŃ锣
²½Öč | ŹµŃé²Ł×÷ | ŹµŃéĻÖĻó |
¢ń | Č”ŹŹĮæ²śĘ·Åä³ÉĻ”ČÜŅŗ£¬µĪ¼Ó×ćĮæBaCl2ČÜŅŗ | ÓŠ°×É«³ĮµķÉś³É |
¢ņ | ¹żĀĖ£¬ÓĆÕōĮóĖ®Ļ“µÓ³Įµķ£¬Ļņ³ĮµķÖŠ¼ÓČė×ćĮæ__________ | ³ĮµķĪ“ĶźČ«Čܽā£¬²¢ÓŠ“Ģ¼¤ŠŌĘųĪ¶µÄĘųĢå²śÉś |
¢Ł²½Öč¢ņÖŠ¼ÓČėµÄŹŌ¼ĮæÉŅŌŹĒ__________£ØĢīŠņŗÅ£©”£
A£®Ļ”ĮņĖį B£®Ļ”ŃĪĖį C£®Ļ”ĻõĖį D£®ĒāŃõ»ÆÄĘČÜŅŗ
¢Ś²½Öč¢ņÉč¼Ę¹żĀĖ²Ł×÷µÄÄæµÄŹĒ£ØÓĆ»Æѧ·½³ĢŹ½¼ņŅŖĪÄ×Ö±ķŹö£©__________”£
£Ø5£©ĪŖ¼õɣװÖĆCÖŠÉś³ÉµÄNa2SO4µÄĮ棬ŌŚ²»øıäŌӊװÖƵĻł“”ÉĻ¶ŌŌŹµŃé²½Öč½ųŠŠĮĖøĽų£¬øĽųŗóµÄ²Ł×÷ŹĒ__________”£
£Ø6£©Na2S2O3³£ÓĆ×÷ĶŃĀČ¼Į”£Na2S2O3ČÜŅŗÓėCl2·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ__________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹÖŠ¶¼ŗ¬ÓŠĒāŌŖĖŲ£¬°“ÕÕŅŃѧÖŖŹ¶ÅŠ¶ĻĘäÖŠŹōÓŚĖįµÄŹĒ£Ø £©
A. NH3 B. CH4 C. NaHCO3 D. HClO3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻņĢå»ż¾łĪŖ10 mL”¢ĪļÖŹµÄĮæÅضČĻąĶ¬µÄĮ½·ŻNaOH ČÜŅŗÖŠ·Ö±šĶØČėŅ»¶ØĮæµÄCO2£¬µĆµ½ČÜŅŗ¼×ŗĶŅŅ”£Ļņ¼×”¢ŅŅĮ½ČÜŅŗÖŠ·Ö±šµĪ¼Ó0.1mol/LµÄŃĪĖį£¬“ĖŹ±·“Ӧɜ³ÉCO2Ģå»ż(±ź×¼×“æö)ÓėĖł¼ÓŃĪĖįĢå»żµÄ¹ŲĻµČēĶ¼ĖłŹ¾”£ŌņĻĀĮŠŠšŹöÖŠ²»ÕżČ·µÄŹĒ

A. ŌNaOHČÜŅŗµÄĪļÖŹµÄĮæÅضČĪŖ0.5 mol/L
B. µ±0ŃĪĖį)<10 mLŹ±£¬¼×ČÜŅŗÖŠ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖH++CO32-=HCO3-
C. ŅŅČÜŅŗÖŠŗ¬ÓŠµÄČÜÖŹŹĒNa2CO3”¢NaOH
D. ĻņŅŅČÜŅŗÖŠµĪ¼Ó¹żĮæŃĪĖįŗó²śÉśCO2Ģå»żµÄ×ī“óÖµĪŖ224 mL
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅ»¶ØĢõ¼žĻĀN2+3H2=2NH3ĪŖ·ÅČČ·“Ó¦£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ( )
A.øĆ·“Ó¦ŹĒæÉÄę·“Ó¦
B.·“Ó¦“ļµ½Ę½ŗāŹ±£¬·“Ó¦ĖŁĀŹĪŖĮć
C.ĒāĘųæÉŅŌĶźČ«×Ŗ»ÆĪŖ°±Ęų
D.·“Ó¦ĪļµÄ×ÜÄÜĮæŠ”ÓŚÉś³ÉĪļµÄ×ÜÄÜĮæ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠÓŠ¹ŲNa2CO3ŗĶNaHCO3µÄŠŌÖŹĖµ·ØÕżČ·µÄŹĒ
A. Čܽā¶Č£ŗNa2CO3£¾NaHCO3
B. ÓŅĶ¼ĖłŹ¾×°ÖĆæÉÖ¤Ć÷ĪČ¶ØŠŌ£ŗNa2CO3£¾NaHCO3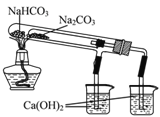
C. ÓĆ³ĪĒåŹÆ»ŅĖ®æɼų±šNa2CO3ČÜŅŗŗĶNaHCO3ČÜŅŗ
D. µČÖŹĮæµÄNa2CO3ŗĶNaHCO3·Ö±šÓė¹żĮæŃĪĖį·“Ó¦£¬·ÅCO2ÖŹĮæĻąĶ¬
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com