
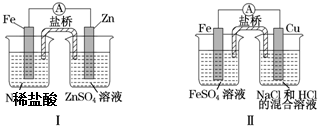
| A. | 装置Ⅰ中铁溶解、锌不溶解,装置Ⅱ中铁溶解、铜不溶解 | |
| B. | 装置Ⅰ中电流表指针不偏转,装置Ⅱ中电流表指针偏转 | |
| C. | 装置Ⅰ和装置Ⅱ中正极反应均是2H++2e-═2H2 | |
| D. | 盐桥中的阳离子均向右侧烧杯移动 |
分析 A、装置Ⅰ中锌与盐酸发生自发的氧化还原反应,所以锌是负极,锌溶解;装置Ⅱ中铁与盐酸发生自发的氧化还原反应;
B、装置Ⅰ和装置Ⅱ都构成原电池,指针都偏转;
C、装置Ⅰ中锌与盐酸发生自发的氧化还原反应,所以锌是负极,锌溶解;装置Ⅱ中铁与盐酸发生自发的氧化还原反应,正极都是氢离子得电子,发生还原反应;
D、装置Ⅰ中正极是右边,装置Ⅱ中右边是正极.
解答 解:A、装置Ⅰ中锌与盐酸发生自发的氧化还原反应,所以锌是负极,锌溶解;装置Ⅱ中铁与盐酸发生自发的氧化还原反应,铁溶解,铜不溶解,故A错误;
B、装置Ⅰ和装置Ⅱ都构成原电池,指针都偏转,故B错误;
C、装置Ⅰ中锌与盐酸发生自发的氧化还原反应,所以锌是负极,锌溶解;装置Ⅱ中铁与盐酸发生自发的氧化还原反应,正极都是氢离子得电子,发生还原反应,电极反应式为:2H++2e-═2H2,故C正确;
D、装置Ⅰ中正极是左边,装置Ⅱ中右边是正极,所以装置Ⅰ盐桥中的阳离子均向左侧烧杯移动,故D错误;
故选:C.
点评 本题考查原电池知识,为高频考点,侧重于学生分析能力和基本理论的理解和运用的考查,注意把握金属的活泼性强弱以及电极方程式的书写,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 糖类、油脂、蛋白质都是高分子化合物,都能发生水解反应 | |
| B. | 淀粉、纤维素水解的最终产物均为葡萄糖 | |
| C. | 由甲烷的氯代物有4种,可推知乙烷的氯代物有6种 | |
| D. | 天然油脂没有固定的熔点和沸点,所以天然油脂是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示.若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示.若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )| A. | X的气态氢化物的水溶液显酸性 | |
| B. | X的原子半径小于Y | |
| C. | Z的最外层电子数比Y多 | |
| D. | W的单质能与水反应,生成一种具有漂白性的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | 实验操作 | 实验现象 |
| a | 分别在试管A、B中加入5mL 5% H2O2溶液,各滴入2滴1mol•L-1 FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡 | 试管A中无明显气泡产生 试管B中出现大量气泡 |
| b | 另取两支试管分别加入5mL 5% H2O2溶液和5mL 10% H2O2溶液 | 两支试管中都未见明显气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaHSO4溶液中滴Ba(OH)2溶液.恰好使溶液呈中性:H++SO42-+Ba2++OH-═H2O+BaSO4↓ | |
| B. | 镁粉撒入NH4Cl溶液:Mg+2H+═Mg2++H2↑ | |
| C. | 过量SO2通入Ca(ClO)2溶液中:ClO-+SO2+H2O═HSO3-+HClO | |
| D. | 向FeI2溶液中通入等量氯气:2I-+C12═I2+2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑥ | B. | ①②③④ | C. | ①②⑥ | D. | ①②③④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com