
| A. | Al2O3$→_{△}^{NaOH(aq)}$NaAlO2$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| B. | Si$→_{△}^{O_{2}}$SiO2$\stackrel{H_{2}O}{→}$H2SiO3 | |
| C. | Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3$\stackrel{△}{→}$无水FeCl3 | |
| D. | MgCl2(aq)$\stackrel{石灰乳}{→}$Mg(OH2)$\stackrel{△}{→}$MgO |
分析 A.氧化铝与氢氧化钠溶液反应生成偏铝酸钠与水,偏铝酸钠溶液与二氧化碳反应生成氢氧化铝;
B.二氧化硅不能与水反应;
C.氯化铁溶液中铁离子水解得到氢氧化铁与HCl,加热HCl挥发、促进水解的彻底进行;
D.氢氧化镁溶解度比氢氧化钙小,符合复分解反应条件,氢氧化镁分解得到氧化镁与水.
解答 解:A.氧化铝属于两性氧化物,能与氢氧化钠溶液反应生成偏铝酸钠与水,偏铝酸钠溶液与二氧化碳反应生成氢氧化铝,符合转化关系,故A正确;
B.Si与氧气可以生成二氧化硅,但二氧化硅不能与水反应,可以向转化为硅酸钠,再加入酸得到硅酸,故B错误;
C.氧化铁与盐酸反应生成氯化铁,氯化铁溶液中铁离子水解得到氢氧化铁与HCl,加热HCl挥发、促进水解的彻底进行,得到氢氧化铁,灼烧氢氧化铁为分解为氧化铁,故C错误;
D.氢氧化镁溶解度比氢氧化钙小,符合复分解反应条件,氯化镁与氢氧化钙反应生成氢氧化镁,加热氢氧化镁分解得到氧化镁与水,符合转化关系,故D正确,
故选:BC.
点评 本题考查元素化合物性质、盐类水解等,难度不大,需要学生熟练掌握元素化合物性质,有利于基础知识的巩固.


科目:高中化学 来源: 题型:选择题
| A. | 硅胶常用作袋装食品的干燥剂,也可用作催化剂的载体 | |
| B. | 过渡元素金属作半导体材料 | |
| C. | 考古时利用14C测定一些文物的年代 | |
| D. | 纯净的SiO2是现代光学及光纤制品的基本原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
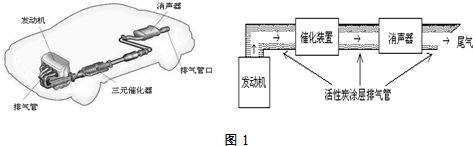
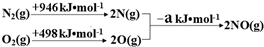
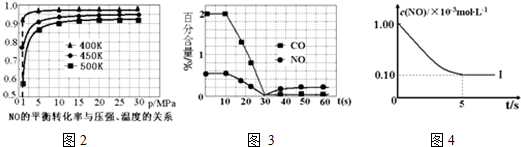
| 实验编号 | T(K) | NO初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂的比表面积(m2/g) |
| Ⅰ | 400 | 1.00×10-3 | 3.60×10-3 | 82 |
| Ⅱ | 400 | 1.00×10-3 | 3.60×10-3 | 124 |
| Ⅲ | 450 | 1.00×10-3 | 3.60×10-3 | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3m+n | B. | $\frac{5}{2}$m+$\frac{1}{2}$n-p | C. | $\frac{5}{2}$m+$\frac{1}{2}$n | D. | 3m+n+2p |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 按要求完成下列问题:
按要求完成下列问题: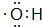 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/K | 298 | 398 |
| 平衡常数K | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com