
| 相关信息 | |
| X | X原子基态时最外层电子数是其内层电子数的2倍 |
| Y | Y原子基态时2p原子轨道上有3个未成对电子 |
| Z | Z的基态原子最外层电子排布式为:nsnnpn+2 |
| W | W的原子序数为24 |
| 4+2 |
| 2 |
| 5+2+1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 8 |
| ||
| (a×10-10)3 |
| 392 |
| NAa3×10-30 |
| ||
| 2 |
| 392 |
| NAa3×10-30 |
| ||
| 2 |


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
 如图所示,其中甲、乙、丙、丁、戊分别是氧化铜、稀盐酸、氢氧化钙溶液、碳酸钠溶液、二氧化碳中的一种.图中相连的两圆表示相应物质能发生反应,已知甲和丁反应有气泡出现.则下列说法正确的是( )
如图所示,其中甲、乙、丙、丁、戊分别是氧化铜、稀盐酸、氢氧化钙溶液、碳酸钠溶液、二氧化碳中的一种.图中相连的两圆表示相应物质能发生反应,已知甲和丁反应有气泡出现.则下列说法正确的是( )| A、甲与丙反应属于中和反应 |
| B、乙和戊都是氧化物 |
| C、丙与丁反应会生成白色沉淀 |
| D、丁和戊反应属于化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100mL 0.5mol?L-1MgCl2溶液 |
| B、200mL 1mol?L-1CaCl2溶液 |
| C、50mL 1mol?L-1NaCl溶液 |
| D、25mL 0.5mol?L-1HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
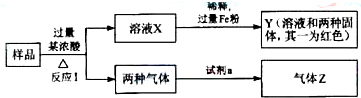
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强电解质溶液的导电性一定比弱电解质强 |
| B、医疗上血液的透析利用了胶体的性质,而用FeCl3紧急止血与胶体的性质无关 |
| C、氯水、氨水是混合物,盐酸是电解质,故盐酸是纯净物 |
| D、胶体与溶液的本质区别是分散质微粒的大小,可利用丁达尔现象区别溶液与胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com