
| 电解质 | 平衡方程式 | 平衡常数K | ||||||
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 | ||||||
| H2CO3 | H2CO3?H++HCO
HCO
|
K1=4.31×10-7 K2=5.61×10-11 | ||||||
| C6H5OH | C6H5OH?C6H5O-+H+ | 1.1×10-10 | ||||||
| NH3?H2O | NH3?H2O?NH4++OH- | 1.76×10-5 |
- 3 |
| c(HCO3-).c(OH-) |
| c(CO32-) |
| c(HCO3-).c(OH-) |
| c(CO32-) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、雾霾天气中的主要污染物是PM2.5,其中含氮的有机物和光发生化学作用,可形成光化学烟雾 |
| B、砷是水污染的重要因素之一,其最高价含氧酸砷酸的酸性比磷酸酸性弱 |
| C、土壤污染物可分为无机污染物和有机污染物,农药污染多为有机污染物 |
D、苏丹红是人工合成的一种工业染料,若掺入饲料中饲养禽类会污染蛋类食品,它的结构简式是 ,其分子式是:C22H18N4O ,其分子式是:C22H18N4O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
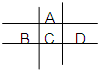 图为周期表的一小部分,A、B、C、D的位置关系如图所示.且它们均为短周期元素,其中C元素的最外层电子数是电子层数的2倍,回答下列问题:
图为周期表的一小部分,A、B、C、D的位置关系如图所示.且它们均为短周期元素,其中C元素的最外层电子数是电子层数的2倍,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 以黄铜矿精矿为原料,制取金属铜的工艺如下所示:
以黄铜矿精矿为原料,制取金属铜的工艺如下所示:查看答案和解析>>
科目:高中化学 来源: 题型:
 生产生活中广泛涉及氧化还原反应.
生产生活中广泛涉及氧化还原反应.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入催化剂,反应途径将发生改变,△H也将随之改变 |
| B、升高温度,正逆反应速率都增大,H2S分解率也增大 |
| C、增大压强,平衡向逆反应方向移动,将引起体系温度降低 |
| D、若体系恒容,注人一些H2后达新平衡,H2浓度将减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硫气体通入到漂白粉溶液中:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| B、碳酸氢镁溶液中加入过量的澄清石灰水:Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O |
| C、H218O中投入Na2O2固体:2H218O+2O22-=4OH-+18O2↑ |
| D、向硫酸氢钠溶液中滴入氢氧化钡溶液至pH=7:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com