
【题目】下列分子或离子的空间构型为平面三角形的是
A.SiH4 B.H3O+ C.SO32- D.NO3-
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是

A. 相比现有工业合成氨,该方法条件温和,同时还可提供电能
B. 阴极区,在氢化酶作用下发生反应H2+2MV2+![]() 2H++2MV+
2H++2MV+
C. 正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D. 电池工作时质子通过交换膜由负极区向正极区移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物是药物生产的中间体,其结构简式如图。下列有关叙述不正确的是( )

A.该有机物与浓溴水可发生取代反应
B.1 mol该有机物与足量NaOH溶液反应最多消耗4 mol NaOH
C.该有机物与浓硫酸混合共热可发生消去反应
D.该有机物经催化氧化后与新制氢氧化铜悬浊液共热生成砖红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某有机物的结构表示为![]() ,其名称是________________________。
,其名称是________________________。
(2)写出下列反应的化学方程式:
①草酸能使酸性高锰酸钾溶液褪色:____________________________________。
②把浓硝酸、浓硫酸和甲苯混合加热制备TNT:______________________________。
③溴乙烷在一定条件下发生消去反应:__________________________________。
(3)某烃A分子中碳的质量分数为90.57%,在某温度下V L该烃的蒸气质量是相同状况下V L H2质量的53倍,则烃A的分子式为______________;若烃A分子中含有苯环,且苯环上的一氯代物只有一种,则A的结构简式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将Ⅰ阀关闭,Ⅱ阀打开,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是
①浓硫酸 ②饱和氯化钠溶液 ③NaOH溶液 ④饱和碳酸钠溶液 ⑤水
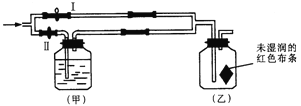
A. ①③ B. ②⑤ C. ②③⑤ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列有关说法正确的是
A. 60g冰醋酸晶体中,含阴离子数目为NA
B. 标准状况下,22.4LCCl4中含有分子的数目为NA
C. 常温下,46gNO2与N2O4混合气体中含分子数为NA
D. 32gCu投入300mL10mol/L的浓硝酸中,充分反应后转移电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g/mL),所得溶液的密度为ρ g/mL,质量分数为w,物质的量浓度为c mol/L,则下列关系中不正确的是
A.c=1 000Vρ/(17V+22 400)B.w=17c/(1000ρ)
C.w=17V/(17V+22 400)D.ρ=(17V+22 400)/(22.4+22.4V)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类最早使用的金属之一。能形成多种化合物,易形成配位化合物。回答下列问题:
(1)Cu位于周期表第四周期第___族。写出其基态原子的电子排布式_____。
(2)元素Ni和Cu如相邻
①Ni和Cu相比,基态原子中未成对电子___.(填“多”“少”或“相等”)。
②第二电离能Cu比Ni高,原因是_____。
(3)Cu可以和EDA(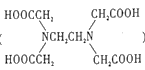 )形成配合物,其中碳原子的杂化方式是____,其中C、N、O的电负性由大到小的顺序是_____。
)形成配合物,其中碳原子的杂化方式是____,其中C、N、O的电负性由大到小的顺序是_____。
(4)CuSO4受热分解的方程式为2CuSO4===Cu2O+SO2↑+SO3↑+O2↑。
①SO2的空间构型为_____,O2中σ和![]() 健的个数比是______。
健的个数比是______。
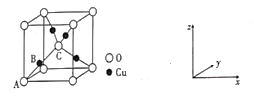
②氧化亚铜的晶胞结如图所示,其中A原子坐标是(0,0,0),C原子坐标是(![]() ,
,![]() ,
,![]() ),则B原子坐标是____。若最近的Cu+与O2-的核距是anm,用NA表示阿伏加德罗常数的值,则氧化亚铜的密度是_____g·cm—3
),则B原子坐标是____。若最近的Cu+与O2-的核距是anm,用NA表示阿伏加德罗常数的值,则氧化亚铜的密度是_____g·cm—3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH===5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。下列说法中正确的是( )
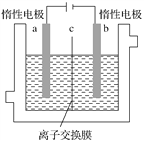
A. 电解过程中OH-从a极区通过离子交换膜c进入b极区
B. 随着电解进行,KOH溶液浓度会逐渐减小
C. a电极反应式:I--6e-+6OH-=== IO![]() +3H2O,a极区的KI最终转变为KIO3
+3H2O,a极区的KI最终转变为KIO3
D. 当阳极有0.1 mol I-放电时,阴极生成6.72 L H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com