
| A、铁作阳极,镀件作阴极,溶液中含有亚铁离子 |
| B、铂作阴极,镀件作阳极,溶液中含有锌离子 |
| C、锌作阳极,镀件作阴极,溶液中含有锌离子 |
| D、锌用阴极,镀件作阳极,溶液中含有锌离子 |
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:
| A、蒸馏水 |
| B、0.5mol?L-1H2SO4溶液 |
| C、0.5 mol?L-1BaCl2溶液 |
| D、1.0mol?L-1H2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、该卤代烃发生水解反应时,被破坏的键是①和② |
| B、该卤代烃发生消去反应时,被破坏的键是①和④ |
| C、该卤代烃发生取代反应时,被破坏的键是① |
| D、该卤代烃发生消去反应时,被破坏的键是①和② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝厂通过电解熔融氧化铝的方法冶炼铝 |
| B、制钠厂通过电解熔融氯化钠的方法生产金属钠 |
| C、用电解饱和食盐水的方法生产烧碱,同时得到氯气和氢气 |
| D、制钠厂通过电解饱和食盐水的方法生产金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、称量时NaOH已经潮解 |
| B、定容时俯视容量瓶的标线 |
| C、向容量瓶中转移溶液时,容量瓶事先用蒸馏水洗涤过 |
| D、摇匀后发现液面低于标线,滴加蒸馏水至标线再摇匀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝制器皿不宜盛放酸性食物 |
| B、电解食盐水时阴极产生氢气 |
| C、可用铁制容器盛放和运输浓硫酸 |
| D、镀锌铁桶镀层破损后铁仍不易被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
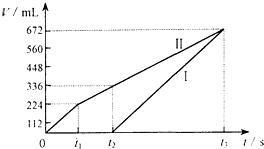 常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:
常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液、蒸发、萃取 |
| B、分液、萃取、加热 |
| C、分液、蒸馏、萃取 |
| D、蒸馏、加热、蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com