
【题目】室温时10mL某气态烃与过量氧气混合,完全燃烧后的产物通过浓硫酸,再恢复到室温,气体体积减少了30mL,剩余气体再通过苛性钠溶液,体积又减少了30mL.求气态烃的分子式及结构简式.
【答案】解:设烃为CxHy ,
CxHy+(x+ ![]() )O2
)O2![]() xCO2+
xCO2+ ![]() H2O(l),△V
H2O(l),△V
1 x+ ![]() x 1+
x 1+ ![]()
10 30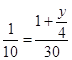 ,解得y=8,
,解得y=8,
剩余气体再通过苛性钠溶液,体积又减少了30mL,减少的气体为二氧化碳,
相同条件下气体的体积之比等于物质的量之比,则该烃中含有C原子数为 ![]() =3,
=3,
所以该有机物分子式为C3H8 , 结构简式为CH3CH2CH3 ,
答:气态烃的分子式为 C3H8 , 结构简式为CH3CH2CH3 .
【解析】室温下气态烃与过量的氧气反应的化学方程式:CxHy+(x+ ![]() )O2
)O2 ![]() xCO2+
xCO2+ ![]() H2O(l),利用差量法计算出有机物分子中的H原子数;再把这些气体通过NaOH溶液气体体积,又减少了30mL,减少的气体为二氧化碳气体体积,据此可计算出该烃中含有C原子数,从而确定该烃的分子式.
H2O(l),利用差量法计算出有机物分子中的H原子数;再把这些气体通过NaOH溶液气体体积,又减少了30mL,减少的气体为二氧化碳气体体积,据此可计算出该烃中含有C原子数,从而确定该烃的分子式.


科目:高中化学 来源: 题型:
【题目】SO2的含量是空气质量日报中一项重要检测指标,请结合所学知识回答下列问题.
(1)工业制硫酸过程中,SO2催化氧化的原理为: 2SO2(g)+O2(g) ![]() 2SO3(g)
2SO3(g)
T℃时,向某密闭容器中充入一定SO2(g)和O2(g),发生上述反应,测得SO2(g)的平衡转化率(a)与体系总压强(p)的关系如图1所示.
①a、b两点对应的平衡常数K(a)K(b)(填“>”、“<”或“=”,下同),SO2浓度c(a)c(b).
②c点时,反应速率v(正)v(逆) .
(2)电化学法处理SO2 . 硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如图2所示(电极均为惰性材料):
①M极发生的电极反应式为 .
②若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为L(已知:1个e﹣所带电量为1.6×10﹣19C).
(3)溶液法处理SO2 . 已知常温下H2SO3和H2CO3的电离常数如表所示:
电离常数 | K1 | K2 |
H2SO3 | 1.3×10﹣2 | 6.3×10﹣8 |
H2CO3 | 4.2×10﹣7 | 5.6×10﹣11 |
常温下,将SO2缓慢通入100mL 0.2molL﹣1的Na2CO3溶液中,当通入448mLSO2时(已折算为标准状况下的体积,下同),发生的离子方程式为;当通入896mLSO2时,所得溶液呈弱酸性,溶液中各离子浓度由大到小的顺序为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在气体参加的反应中,能使反应物中活化分子数和活化分子百分数都增大的方法是( )
①增大反应物浓度 ②增大压强 ③升高温度 ④加入催化剂 ⑤移去生成物.
A.①②③
B.②③④
C.①③④
D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知如下反应,回答下列问题:
3I2 + 6NaOH = 5NaI + NaIO3 + 3H2O
(1)画出这个反应的双线桥___________
(2)_______是氧化剂,氧化产物是___________;
(3)氧化剂与还原剂的物质的量之比为____________,当反应消耗3mol NaOH时,转移的电子数目为_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂质的方法可行的是( )
A. 除去CO2中混有的少量CO,通入适量氧气后点燃
B. 用溶解、过滤的方法分离KNO3和NaCl固体的混合物
C. 除去乙醇中的少量水,可以加入生石灰再蒸馏
D. 用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定物质的量浓度的NaOH 溶液1 00mL,然后向其通入一定量的CO2气体,得到溶液A,向A中逐滴缓慢加入0.1mol/L的HCl溶液,产生的CO2气体体积(标准状况)与所加HCl溶液的体积之间关系如图所示,下列有关说法不正确的是( ) 
A.A溶液中溶质Na2CO3和NaHCO3物质的量比为l:l
B.A溶液中溶质NaOH和Na2CO3物质的量比为l:l
C.原Na0H 溶液物质的量浓度为0.075mol/L
D.通入CO2气体在标况下的体积为56mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com