
��ͼ���漰�����ʾ�Ϊ��ѧ��ѧ�еij������ʣ�����CΪO2��DΪCl2��EΪFe���ʣ����Ǵ�������ת����ϵ����Ӧ�����ɵ�ˮ����Ҫ���������ȥ��
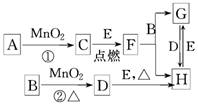
(1)д���й����ʵ����ƻ�ѧʽ��B__________��F______________��H______________.
(2)ָ��MnO2����ط�Ӧ�е����ã���Ӧ������________________________������Ӧ������________����
(3)����Ӧ�����ڼ��������½��еģ���A��________������Ӧ�����ڳ��������½��еģ���A��________��
(4)д��B��MnO2���Ȼ��D�Ļ�ѧ����ʽ��___________________________________
________________________________________________________________________.
(1)���ᡡFe3O4��FeCl3��(2)��������
(3)KClO3��H2O2
(4)MnO2��4HCl(Ũ)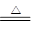 MnCl2��Cl2����2H2O
MnCl2��Cl2����2H2O
����������CΪO2��DΪCl2��EΪ Fe�����ݿ�ͼת����ϵ����֪��A����ΪKClO3��H2O2��BΪ���ᣬFΪFe3O4��GΪFeCl2.����Ӧ���ڼ��������½���ʱ��AΪKClO3�������ڳ��������½���ʱ��AΪH2O2�����ڷ�Ӧ��MnO2�������������ڷ�Ӧ����MnO2Ϊ����������HCl����ΪCl2.



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ͼ���漰�����ʾ�Ϊ��ѧ��ѧ�еij������ʣ�����C��DΪ���嵥�ʣ�E��Ŀǰ����Ӧ����㷺�Ľ���������Ϊ��������Ǵ�����ͼת����ϵ����Ӧ�����ɵ�ˮ����Ҫ���������ȥ��
��ͼ���漰�����ʾ�Ϊ��ѧ��ѧ�еij������ʣ�����C��DΪ���嵥�ʣ�E��Ŀǰ����Ӧ����㷺�Ľ���������Ϊ��������Ǵ�����ͼת����ϵ����Ӧ�����ɵ�ˮ����Ҫ���������ȥ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ͼ���漰�����ʾ�Ϊ��ѧ��ѧ�еij������ʣ�����C��DΪ�ǽ����������壬EΪ�������ʣ�����Ϊ��������Ǵ�������ת����ϵ����Ӧ�����ɵ�ˮ����Ҫ���������ȥ��
��ͼ���漰�����ʾ�Ϊ��ѧ��ѧ�еij������ʣ�����C��DΪ�ǽ����������壬EΪ�������ʣ�����Ϊ��������Ǵ�������ת����ϵ����Ӧ�����ɵ�ˮ����Ҫ���������ȥ��
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com