
【题目】离子方程式Ba2++SO42-=BaSO4↓可以表示( )
①可溶性钡盐溶液与可溶性硫酸盐溶液之间的反应
②氢氧化钡溶液与可溶性硫酸盐溶液之间的反应
③稀硫酸与可溶性钡盐溶液之间的反应
④氢氧化钡溶液与稀硫酸之间的反应
A.①B.①②④C.②③D.①②③
【答案】A
【解析】
离子方程式Ba2++![]() =BaSO4↓表示易溶易电离出Ba2+的化合物与易溶易电离出
=BaSO4↓表示易溶易电离出Ba2+的化合物与易溶易电离出![]() 的化合物反应生成硫酸钡沉淀的离子反应。
的化合物反应生成硫酸钡沉淀的离子反应。
①可表示;
②若为Ba(OH)2溶液与MgSO4溶液反应,除生成BaSO4外,还生成Mg(OH)2沉淀,不可表示;
③稀硫酸与可溶性钡盐溶液之间的反应,如稀硫酸与醋酸钡的反应为:2H++SO42-+Ba2++2CH3COO-=BaSO4↓+2CH3COOH,不能用离子方程式Ba2++SO42-=BaSO4↓来表示,③不可表示;
④Ba(OH)2溶液与稀硫酸反应除了生成BaSO4沉淀外,还生成水,其离子方程式为Ba2++2OH-+2H++![]() =BaSO4↓+2H2O,不可表示;
=BaSO4↓+2H2O,不可表示;
答案为A。


科目:高中化学 来源: 题型:
【题目】汽车常用蓄电池其结构如图所示,放电时反应如下: PbO2+Pb+2H2SO4=2PbSO4+2H2O。根据此反应判断,下列叙述中不正确的是
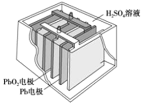
A.Pb 作为负极,失去电子,被氧化
B.电池放电时,溶液酸性增强
C.负极反应是 Pb+SO42-–2e-=PbSO4
D.PbO2 得电子,被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属及其化合物的应用不合理的是( )
A. 将废铁屑加入![]() 溶液中,可用于除去工业废气中的
溶液中,可用于除去工业废气中的![]()
B. 铝中添加适量锂,制得低密度、高强度的铝合金,可用于航空工业
C. 盐碱地(含较多![]() 等)不利于作物生长,可施加熟石灰进行改良
等)不利于作物生长,可施加熟石灰进行改良
D. 无水![]() 呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A.2.24L(标准状况下)苯在O2中完全燃烧,得到0.6NA个CO2分子
B.1mol乙酸(忽略挥发损失)与足量的C2H518OH在浓硫酸作用下加热,充分反应可生成NA个CH3CO18OC2H5分子
C.14g乙烯和丙烯混合气体中的氢原子数为2NA
D.标准状况下,11.2LCCl4中含分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不可能通过一步反应直接完成的是
A. Al(OH)3 → Al2O3 B. Al2O3 → Al(OH)3
C. Al → AlO2- D. Al3+ → Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个制取氯气并以氯气为原料进行特定反应的装置。
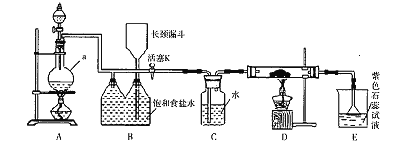
(l)A是氯气发生装置,写出其中的化学反应方程式___________。
(2)a仪器的名称为___________。
(3)实验开始时,先点燃A处的酒精灯,打开活塞K,让氯气充满整个装置,再点燃D处酒精灯,连接上E装置。D装置的硬质玻璃管内盛有炭粉,反应产物为CO2和HC1。写出D中反应的化学方程式_________,装置C的作用是__________。
(4)在E处,若漏斗内气体带有黄绿色,则紫色石蕊试液的颜色变化为_______。
(5)若将E处烧杯中溶液改为澄清石灰水,反应过程中现象为___________(填序号)。
①有白色沉淀生成;②无白色沉淀生成;③先生成白色沉淀,而后白色沉淀消失。
(6)D处反应完毕后,关闭活塞K,移去酒精灯,由于余热的作用,A处仍有Cl2产生,则装置B中的现象是________;若发现装置B中该现象不明显,可能的原因是________;查找原因时可用肥皂水或湿润的碘化钾淀粉试纸等,若用蘸有浓氨水的玻璃棒检查时观察到有白烟产生,写出该氧化还原反应的化学方程式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A.对于2HI(g)![]() H2(g)+ I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+ I2(g),达平衡后,缩小容器体积可使体系颜色变深
B.合成氨反应中为提高氨的产率,理论上应采取降低温度的措施
C.实验室配制FeCl3溶液时,将FeCl3固体加入到少量的浓盐酸中再加水稀释
D.用饱和食盐水可以去除Cl2中的HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱和小苏打都是重要的化工原料,在生产和生活中有着广泛的应用。
(1)用洁净的铂丝蘸取Na2CO3溶液置于酒精灯火焰上灼烧,火焰呈__________色。
(2)实验室中需0.2mol/L的Na2CO3溶液950mL,配制时应选用容量瓶的规格和称取Na2CO3的质量分别是__________。
A.1000mL;21.2g B.950mL;20.14g C.500mL;21.2g D.500mL;10.6g
(3)若加热10.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了2.48g,则原混合物中碳酸钠的质量分数为______。
(4)某同学为确定一包可能由碳酸钠和碳酸氢钠组成的白色混合物的成分,他取少量该白色物质溶于水,并向所得溶液中加入适量澄清石灰水,产生白色沉淀,据此该同学认为有碳酸钠。你是否同意该同学的观点,请你用适当的化学方程式阐述你的观点________。
(5)取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,试回答下列问题:
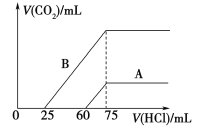
①曲线A表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为_______mL。
②曲线B表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是________,其物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列实验事实的理论解释错误的是( )
选项 | 实验事实 | 理论解释 |
A | 酸性:H2SO4>H2SO3 | H2SO4非羟基氧原子个数大于H2SO3,中心原子正电性越高,酸性越强 |
B | Be单质能溶于KOH溶液 | Be和Al在周期表中是对角线关系,性质相似 |
C | Al原子的第一电离能大于Mg原子 | Mg的金属性比Al强,更容易失去电子 |
D | 沸点:对羟基苯甲醛>邻羟基苯甲醛 | 对羟基苯甲醛存在分子间氢键,邻羟基苯甲醛存在分子内氢键,分子间氢键对它们沸点的影响大于分子内氢键对它们沸点的影响 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com