
| A. | A、C的氧化物均含离子键 | |
| B. | C离子的半径小于D离子的半径 | |
| C. | A、B可形成多种原子个数比为1:1的化合物 | |
| D. | 含D元素的盐溶液只能显酸性 |
分析 A、B、C、D是短周期中原子序数依次增大的四种主族元素.元素D是地壳中含量最多的金属元素,则D为Al元素;B原子最外层电子数是其电子层数的2倍,B为C元素;C在同周期的主族元素中原子半径最大,C为Na元素;A单质在常温下呈气态,则A为H元素,以此解答该题.
解答 解:由上述分析可知,A为H,B为C,C为Na,D为Al,
A.A的氧化物为水或过氧化氢,不含离子键,故A错误;
B.具有相同电子排布的离子中原子序数大的离子半径小,则C离子的半径大于D离子的半径,故B错误;
C.A、B可形成多种原子个数比为1:1的化合物,如乙炔、苯等,故C正确;
D.氯化铝溶液显酸性,偏铝酸钠溶液显碱性,故D错误;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素的性质推断元素为解答本题的关键,侧重分析与应用的考查,注意元素化合物知识的应用,题目难度不大.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:解答题
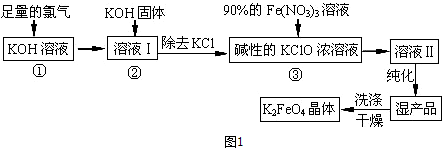
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用葡萄糖制镜或保温瓶胆 | B. | 用Na2S除去废水中的Hg2+ | ||
| C. | Na2O2作供氧剂 | D. | SO2漂白织物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人体必需的营养素有五种,分别为:糖类、油脂、蛋白质、维生素、矿物质(无机盐) | |
| B. | 缺钙会引起骨质疏松,可通过饮用 Ca2+含量高的硬水来补充 | |
| C. | 青少年正处在长身体时期,所以应多吃米饭和肉,少吃蔬菜水果 | |
| D. | 每一种食物含有多种营养素,每种营养素又存在于多种食物中,因此对营养素的摄取应综合考虑 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 设计如图所示实验装置,夹子在实验开始时处于关闭状态,将液体A滴入烧瓶与气体B充分反应;当打开夹子后发现试管内的水立刻沸腾.则液体A和气体B的组合不可能是( )
设计如图所示实验装置,夹子在实验开始时处于关闭状态,将液体A滴入烧瓶与气体B充分反应;当打开夹子后发现试管内的水立刻沸腾.则液体A和气体B的组合不可能是( )| A. | 水、氯化氢 | B. | 稀硫酸、氨气 | ||
| C. | 氢氧化钠溶液、SO2 | D. | 氢氧化钠溶液、CO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
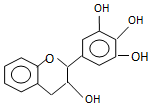 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如下图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如下图所示.关于EGC的下列叙述中正确的是( )| A. | 分子中所有的原子共面 | |
| B. | 遇FeCl3溶液发生显色反应 | |
| C. | 易发生取代反应,难发生氧化反应和加成反应 | |
| D. | 1molEGC与4molNaOH恰好完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②④ | C. | ①② | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用图所示装置可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. |  用图所示装置可降低金属铁的腐蚀速率 | |
| C. |  用图所示装置可测量强酸强碱的中和热 | |
| D. |  用图所示装置可制备Fe(OH)2并能较长时间观察其颜色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com