
| A、明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
| B、在海轮外壳上镶入锌块,可减缓船体的腐蚀 |
| C、电解MgCl2饱和溶液,可制得金属镁 |
| D、MgO的熔点很高,可用于制作耐高温材料 |


科目:高中化学 来源: 题型:
| A、苯分子是碳碳单双键交替相连的结构,因此苯环上碳碳键的键长都不相等 |
| B、甲烷分子是以碳原子为中心的四面体结构,CCl4却不是正四面体结构 |
C、 属于脂环化合物 属于脂环化合物 |
| D、苯是一种无色液体,难溶于水,密度比水小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.104 | 0.111 | 0.066 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A、R的氧化物及其对应的水化物均具有两性 |
| B、L、M的单质均用电解其熔融盐的方法冶炼 |
| C、T的氢化物还原性及稳定性均比Q的氢化物强 |
| D、五种元素的常见简单离子中半径最大的是Q2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
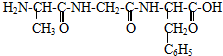
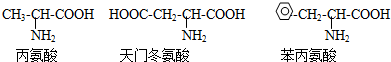
| A、D-12 | ||
| B、D-13 | ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+ H+ Cl- NO3- |
| B、Na+ Mg2+ Cl- SO42- |
| C、K+ Ba2+ OH- I- |
| D、K+ S2- Br- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、③④ | D、④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,1L pH=1的硫酸溶液中含有的H+为0.1NA |
| B、常温下,14g C2H4和C3H6的混合气体中含有2NA个氢原子 |
| C、2.3g Na和足量的O2完全反应,在常温和燃烧时,转移电子数均为0.1NA |
| D、1mol甲醇中含有C-H键的数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| A | 该元素有一种核素质量数为1 |
| B | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| C | 形成的简单离子是第三周期元素形成简单离子半径中最小的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ;
;| 浓H2SO4 |
| △ |
| CH3OH |
| 浓H2SO4,△ |

 和
和 也可以发生类似反应①的反应,有机产物的结构简式为
也可以发生类似反应①的反应,有机产物的结构简式为查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com