
(16分)有机物I是制备液晶材料的重要中间体,其合成途径如下:
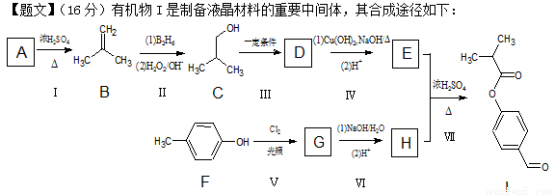
已知:一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
请回答下列问题:
(1)A的核磁共振氢谱有2种峰,则A的结构简式为 。
(2)C的系统命名法为 。
(3)反应Ⅳ在(1)条件下的离子方程式为 。
(4)反应Ⅰ→Ⅴ中属于氧化反应的有 。
(5)根据反应Ⅱ的信息完成以下反应方程式:
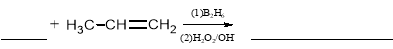 。
。
(6)为反应Ⅲ设计所需试剂与条件是: 。
(7)已知X为E的同分异构体,X与硬酯酸甘油脂具有相同的官能团,还能发生银镜反应。写出所有满足条件的X的结构简式: 。
(16分)(1)(CH3)3COH(2分)(2)2-甲基-1-丙醇(2分)
(3)(CH3)2CHCHO + 2Cu(OH)2 + OH-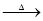 (CH3)2CHCOO- + Cu2O↓ + 3H2O(2分)
(CH3)2CHCOO- + Cu2O↓ + 3H2O(2分)
(4)Ⅲ、Ⅳ(2分) (5)H2O, CH3CH2CH2OH(2分)
(6)O2(2分) 、 催化剂(Cu或Ag)及加热(2分)
(7)HCOOCH2CH2CH3和HCOOCH(CH3)2(2分)
【解析】
试题分析:(1)A在浓硫酸的作用下反应生成2-甲基丙烯,这说明A是丁醇,A的核磁共振氢谱有2种峰,则A的结构简式为(CH3)3COH;
(2)根据C的结构简式可知,C的系统命名法为2-甲基-1-丙醇;
(3)D能与新制的氢氧化铜悬浊液反应,说明含有醛基。则根据C的结构简式可知,D的结构简式为(CH3)2CHCHO,与新制氢氧化铜悬浊液反应的离子方程式为(CH3)2CHCHO + 2Cu(OH)2 + OH-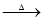 (CH3)2CHCOO- + Cu2O↓ + 3H2O;
(CH3)2CHCOO- + Cu2O↓ + 3H2O;
(4)反应Ⅴ中的反应条件是光照,说明该反应是甲基上的氢原子被氯原子取代,则反应Ⅰ→Ⅴ的反应类型分别是消去反应、加成反应、氧化反应、氧化反应、取代反应,因此属于氧化反应的是Ⅲ、Ⅳ;
(5)反应Ⅱ是在催化剂的作用下烯烃与水的加成反应,且羟基连在含氢原子数比较多的碳原子上,则该反应的方程式可表示为H2O+CH3CH=CH2 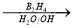 CH3CH2CH2OH;
CH3CH2CH2OH;
(6)反应Ⅲ是醇的催化氧化,因此反应条件是O2、 催化剂(Cu或Ag)及加热;
(7)X与硬酯酸甘油脂具有相同的官能团,还能发生银镜反应,说明含有酯基和醛基,因此是甲酸形成的酯,则符合条件的有机物结构简式为HCOOCH2CH2CH3和HCOOCH(CH3)2。
考点:考查有机物推断、命名、反应类型、同分异构体、反应条件判断以及方程式书写等


科目:高中化学 来源:2015届湖北省四校高三上学期期中联考化学试卷(解析版) 题型:填空题
(12分)某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
阴离子 | Cl- CO32- NO3- SO42- SiO32- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是 (写离子符号)。
(2)Ⅲ中加入少量盐酸生成无色气体的的离子方程式是_________________________。
(3)将Ⅲ中红棕色气体(标况下)收集一满试管然后倒扣入水中(假设溶质不扩散),所得溶液的物质的量浓度为 mol/L(精确到千分位)
(4)甲同学最终确定原溶液中所含阳离子是 ,阴离子是 。(写离子符号)
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为 g。
查看答案和解析>>
科目:高中化学 来源:2015届海南省高三第四次月考化学试卷(解析版) 题型:计算题
一定条件下1molN2和4mol H2通入到V升的容器中发生反应,反应前容器中的压强为P,保持温度和体积不变,10min后反应达到平衡,此时容器内混合气体平均相对分子质量为9,试求
(1)平衡时,体系内压强为多少?
(2)平衡时,氨气的体积分数为多少?
查看答案和解析>>
科目:高中化学 来源:2015届海南省高三第四次月考化学试卷(解析版) 题型:选择题
向含有FeCl3、BaCl2的酸性溶液中通入SO2气体会有沉淀产生,该沉淀是
A.BaSO4 B.FeS C.BaSO3 D.S
查看答案和解析>>
科目:高中化学 来源:2015届海南省高三第四次月考化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.1 mol H2O的质量为18g/mol
B.标准状况下,1 mol任何物质体积均为22.4L
C.3.01×1023个SO2分子的质量为32g
D.CH4的摩尔质量为16g
查看答案和解析>>
科目:高中化学 来源:2015届浙江省协作体高三第一次适应性测试理科综合化学卷(解析版) 题型:选择题
已知25℃时Mg(OH)2的Ksp为5.6×10-12mol3·L-3,MgF2的Ksp为7.4×10-11mol3·L-3。下列说法中正确的是( )
A.25℃时,Mg(OH)2固体在氨水中的Ksp比在NH4Cl溶液中的Ksp小
B.25℃时,向Mg(OH)2的澄清饱和溶液中加入少量NH4Cl固体,c(Mg2+)减小
C.25℃时,Mg(OH)2的溶解能力大于MgF2的溶解能力
D.25℃时,饱和Mg(OH)2溶液与0.1mol·L-1NaF溶液等体积混合,能生成MgF2沉淀
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期回头考试化学试卷(解析版) 题型:填空题
过氧化氢和臭氧是用途很广的氧化剂。试回答下列问题:
(1)过氧化氢是一种绿色氧化剂,写出在酸性条件下H2O2氧化氯化亚铁的离子反应方程式:
(2)Na2O2 、K2O2、 以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是____________(写电子式),
臭氧(O3)可以使湿润的淀粉-碘化钾试纸变蓝,反应的化学方程式为:
KI+O3+H2O→KOH+I2+O2(未配平 ) 回答问题:
① 还原产物的化学式为
② 配平后的化学方程式是
(4)O3 可由臭氧发生器(原理如下图所示)电解稀硫酸制得。
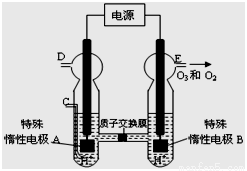
①图中阴极为 (填“A”或“B”)。
② 若C处不通入O 2 ,D、E处分别收集到11.2L和有4.48L
气体(标准状况下), 则E处收集的气体中O3所占的体积分数
为 (忽略 O 3 的分解)。
③ 若C处通入O 2,则A极的电极反应式为: 。
(5)新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx 95%以上是以NO形式存在的,可发生反应NO(g)+ O3 (g) NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是
NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是
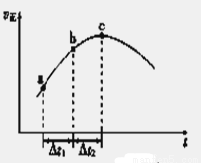
a.反应在c点达到平衡状态
b.反应物浓度:b点小于c点
c.反应物的总能量低于生成物的总能量
d.Δt1=Δt2时,NO的转化率:a~b段小于b~c段
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期回头考试化学试卷(解析版) 题型:选择题
右图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系。该溶液的成分可能是 ( )

A.NH4Al(SO4)2 B.KAl(SO4)2
C.Al2(SO4)3 D.NaAlO2
查看答案和解析>>
科目:高中化学 来源:2015届浙江省温州市十校联合体高三上学期期中联考化学试卷(解析版) 题型:选择题
已知反应X (g) + Y (g)  n Z (g) △H > 0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是( )
n Z (g) △H > 0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是( )

A.反应方程式中n = 1
B.10 min时,曲线发生变化的原因是升高温度
C.10 min时,曲线发生变化的原因是增大压强
D.0~5 min内,用X表示的反应速率为v(X) = 0.08 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com